题目内容
有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的分子量与X最高价氧化物的分子量之比为17:40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子.试回答:
(1)写出各元素符号:X 、Y 、Z .
(2)X离子的结构示意图为 .X与Y形成的离子化合物的电子式为 ,Z和氢形成的化合物的电子式为 .
(3)Y单质在空气中燃烧的化学方程式为 ,生成物与水反应的化学方程式为 .
(1)写出各元素符号:X
(2)X离子的结构示意图为
(3)Y单质在空气中燃烧的化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,该氢化物中X化合价为-2价,则X属于第VIA族元素;其最高价氧化物分子式为XO3,此氢化物的分子量与X最高价氧化物的分子量之比为17:40,设X相对原子质量为a,(a+2):(a+48)=17:40,则a=32,X原子核内质子数与中子数相等,所以X质子数为16,则X为S元素;
Y与X可以形成离子化合物Y2X,Y属于第IA族元素,Y的阳离子电子层结构与Ne相同,则Y为Na元素;
Z与X同周期,其气态单质是双原子分子,两原子共用1对电子,则Z是Cl元素;
(1)根据分析书写元素符号;
(2)X为S元素,X离子核内有16个质子、核外有3个电子层最外层有8个电子,据此书写其离子结构示意图;
S与Na形成离子化合物Na2S,钠离子和硫离子之间存在离子键;
Cl和氢形成的化合物HCl分子中H原子和Cl原子之间共用一对电子;
(3)Na在空气中燃烧生成淡黄色固体过氧化钠,过氧化钠和水反应生成NaOH和氧气.
Y与X可以形成离子化合物Y2X,Y属于第IA族元素,Y的阳离子电子层结构与Ne相同,则Y为Na元素;
Z与X同周期,其气态单质是双原子分子,两原子共用1对电子,则Z是Cl元素;
(1)根据分析书写元素符号;
(2)X为S元素,X离子核内有16个质子、核外有3个电子层最外层有8个电子,据此书写其离子结构示意图;
S与Na形成离子化合物Na2S,钠离子和硫离子之间存在离子键;
Cl和氢形成的化合物HCl分子中H原子和Cl原子之间共用一对电子;
(3)Na在空气中燃烧生成淡黄色固体过氧化钠,过氧化钠和水反应生成NaOH和氧气.
解答:
解:有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,该氢化物中X化合价为-2价,则X属于第VIA族元素;其最高价氧化物分子式为XO3,此氢化物的分子量与X最高价氧化物的分子量之比为17:40,设X相对原子质量为a,(a+2):(a+48)=17:40,则a=32,X原子核内质子数与中子数相等,所以X质子数为16,则X为S元素;
Y与X可以形成离子化合物Y2X,Y属于第IA族元素,Y的阳离子电子层结构与Ne相同,则Y为Na元素;
Z与X同周期,其气态单质是双原子分子,两原子共用1对电子,则Z是Cl元素;
(1)通过以上分析知,X是S元素、Y是Na元素、Z是Cl元素,
故答案为:S;Na;Cl;
(2)X为S元素,X离子核内有16个质子、核外有3个电子层最外层有8个电子,硫离子结构示意图为 ;
;
S与Na形成离子化合物Na2S,钠离子和硫离子之间存在离子键,电子式为 ;
;
Cl和氢形成的化合物HCl分子中H原子和Cl原子之间共用一对电子,电子式为 ,
,
故答案为: ;
; ;
; ;
;
(3)Na在空气中燃烧生成淡黄色固体过氧化钠,反应方程式为2Na+O2
Na2O2,过氧化钠和水反应生成NaOH和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na+O2
Na2O2;2Na2O2+2H2O=4NaOH+O2↑.
Y与X可以形成离子化合物Y2X,Y属于第IA族元素,Y的阳离子电子层结构与Ne相同,则Y为Na元素;
Z与X同周期,其气态单质是双原子分子,两原子共用1对电子,则Z是Cl元素;
(1)通过以上分析知,X是S元素、Y是Na元素、Z是Cl元素,
故答案为:S;Na;Cl;
(2)X为S元素,X离子核内有16个质子、核外有3个电子层最外层有8个电子,硫离子结构示意图为
 ;
;S与Na形成离子化合物Na2S,钠离子和硫离子之间存在离子键,电子式为
 ;
;Cl和氢形成的化合物HCl分子中H原子和Cl原子之间共用一对电子,电子式为
 ,
,故答案为:
 ;
; ;
; ;
;(3)Na在空气中燃烧生成淡黄色固体过氧化钠,反应方程式为2Na+O2
| ||
故答案为:2Na+O2
| ||
点评:本题考查位置结构性质相互关系及应用,涉及钠及其化合物的性质、化学用语等知识点,明确物质结构、原子结构及物质性质即可解答,知道离子化合物和共价化合物电子式的区别,题目难度不大.

练习册系列答案
相关题目
设 NA为阿伏加德罗常数,下列有关叙述正确的是( )
| A、78g过氧化钠晶体中,含NA个阴离子 |
| B、56gFe 与稀 H N03 完全反应时一定转移3NA个电子 |
| C、常温常压下,22.4L氦气含有NA个氦原子 |
| D、已知热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol (Q>0),则将 2NA 个SO2分子和 NA 个O2分子置于一密闭容器中充分反应后放出QkJ的热量 |
NA是阿伏加德罗常数,据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
| A、N4和N2是互为同位素 |
| B、1mol N4分子含有28NA个电子 |
| C、相同质量的N4和N2所含原子个数比为2:1 |
| D、N4的摩尔质量是56g |
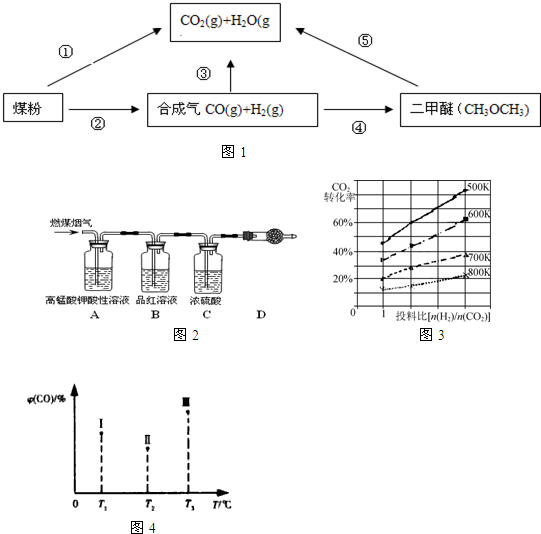
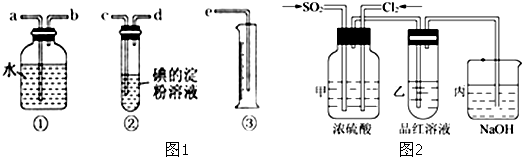

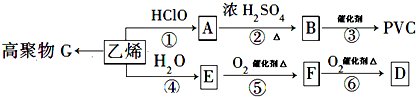
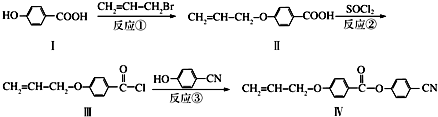
 也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是