题目内容
17.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )| A. | H2O2分子中只存在极性键 | B. | NH3的结构式为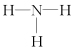 | ||
| C. | HCl的电子式为 | D. | 每个水分子内含有2个氢键 |
分析 A.双氧水分子中的O-O键为非极性键;
B.将分子中所有共价键用短线连接即为结构式;
C.氯化氢为共价化合物,分子中不存在阴阳离子;
D.氢键为水分子之间形成的作用力,不是分子内.
解答 解:A.H2O2分子中的H-O键为极性键,O-O键为非极性键,故A错误;
B.NH3分子中含有3个N-H,其结构式为: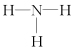 ,故B正确;
,故B正确;
C.氯化氢为共价化合物,氯原子最外层达到8个电子稳定结构,氯化氢正确的电子式为 ,故C错误;
,故C错误;
D.氢键为分子之间的作用力,水分子内不形成氢键,故D错误;
故选B.
点评 本题考查常见化学用语的表示方法,题目难度不大,涉及电子式、结构式、化学键、氢键等知识,明确常见化学用语的概念及书写原则为解答关键,试题有利于提高学生的规范答题能力.

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
8. 常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示.反应过程中有红棕色气体产生.下列说法错误的是( )
常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示.反应过程中有红棕色气体产生.下列说法错误的是( )
 常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示.反应过程中有红棕色气体产生.下列说法错误的是( )
常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示.反应过程中有红棕色气体产生.下列说法错误的是( )| A. | t1时刻前,A1片的电极反应为:2A1-6e-+3H2O═A12O3+6H+ | |
| B. | t1时,因A1在浓硝酸中钝化,氧化膜阻碍了A1继续反应 | |
| C. | t1之后,负极Cu失电子,电流方向发生改变 | |
| D. | 烧杯中发生的离子反应为:2NO2+2OH-═2NO3-+H2O |
8.下列对一些客观事实和理论解释正确的是( )
| 选项 | 事实 | 理论解释 |
| A | Na 与水反应失去 1 个电子,Mg 与水反应失去 2 个电子 | Na 的金属性比 Mg 强 |
| B | H2S 的还原性比 HCl | S 的非金属性比 Cl |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子 |
| D | Si 是半导体材料,同主族的 Ge 也 是半导体材料 | ⅣA 元素形成的单质都是半导体材料 |
| A. | A | B. | B | C. | C | D. | D |
5.下列实验操作或装置正确的是( )
| A. |  点燃酒精灯 | B. |  往试管中加入锌粒 | ||
| C. |  称量氢氧化钠 | D. |  收集氧气 |
12.下列说法正确的是( )
| A. | 因SiO2不溶于水,故H2SiO3不是SiO2对应的酸,或者说SiO2不是H2SiO3的酸酐 | |
| B. | CO2通入Na2SiO3溶液中可以得到硅酸 | |
| C. | 因为高温时SiO2与Na2CO3反应生成CO2,故硅酸的酸性比碳酸强 | |
| D. | 硅的性质稳定,所以在自然界中可以以游离态存在 |
2.为了提纯表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 甲烷(乙烯) | 酸性KMnO4溶液 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | 苯(甲苯) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | 溴水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
9.常温下,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液,含A元素的有关微粒的物质的量变化如图.根据图示判断,下列说法正确的是 ( )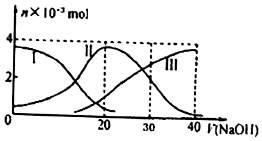

| A. | H2A在水中的电离方程式是:H2A═H++HA-、HA-?H++A2- | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+ )+c(HA- )+2c(H2A)═c(A2- )+2c(OH-) | |
| D. | 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)>c(OH-) |
7.下列说法不能说明H3PO4的酸性弱于H2SO4的是( )
| A. | 非金属性P<S | |
| B. | Na3PO4溶液呈碱性,Na2SO4溶液呈中性 | |
| C. | H3PO4溶液的导电能力弱于H2SO4溶液 | |
| D. | H2SO4溶液与Na3PO4反应可以生成H3PO4和Na2SO4 |
