题目内容
7.下列说法不能说明H3PO4的酸性弱于H2SO4的是( )| A. | 非金属性P<S | |
| B. | Na3PO4溶液呈碱性,Na2SO4溶液呈中性 | |
| C. | H3PO4溶液的导电能力弱于H2SO4溶液 | |
| D. | H2SO4溶液与Na3PO4反应可以生成H3PO4和Na2SO4 |
分析 A.非金属性越强,对应最高价含氧酸的酸性越强;
B.弱酸对应的盐可发生水解反应;
C.溶液导电性与离子浓度大小有关,与强弱电解质没有必然关系;
D.溶液中发生强酸制取弱酸的反应.
解答 解:A.非金属性P<S,则H3PO4的酸性弱于H2SO4,故A不选;
B.Na3PO4溶液呈碱性,Na2SO4溶液呈中性,可知硫酸为强酸,磷酸不是强酸,故B不选;
C.H3PO4溶液的导电能力弱于H2SO4溶液,溶液导电性与离子浓度大小有关,不能判断酸性强弱,故C选;
D.H2SO4溶液与Na3PO4反应可以生成H3PO4和Na2SO4,为强酸制取弱酸的反应,则H3PO4的酸性弱于H2SO4,故D不选;
故选C.
点评 本题考查酸性强弱比较,为高频考点,把握元素非金属性的比较方法、强酸制取弱酸的规律及盐类水解为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
17.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
| A. | H2O2分子中只存在极性键 | B. | NH3的结构式为 | ||
| C. | HCl的电子式为 | D. | 每个水分子内含有2个氢键 |
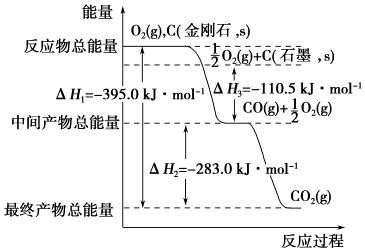
18.闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质.软锰矿的主要成分为 MnO2;含少量A12O3和SiO2.现以闪锌矿和软猛矿为原料制备Zn和MnO2,其简化流程如图1(中间产物的固体部分已经略去).
已知:I.矿石中所有金属元素在滤液中均以离子形式存在.
Ⅱ.各种金属离子完全沉淀的pH如表:
回答下列问题:
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式3MnO2+2FeS+6H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$3MnSO4+Fe2(SO4)3+2S+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是Cu、Cd.
(3)步骤③与MnO2发生氧化还原反应的离子方程式MnO2+2Fe2++4H+=2Fe3++Mn 2++2H2O,物质X可以是BD(用字母表示.
A.Cu2(OH)2CO3 B.MnCO3 C.MgO D.Zn(OH)2
(4)流程中可以循环利用的物质是H2SO4(填化学式).
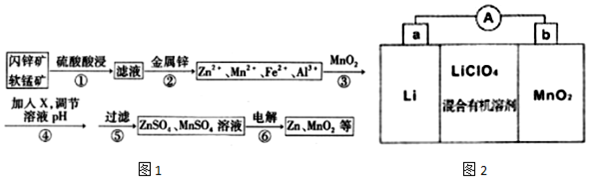
(5)MnO2与Li构成LiMnO2,该电池反应原理如图2所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
①外电路中的电子移动方向是由a极流向b极(填字母).
②写出该锂离子电池的正极电极反应式MnMnO2+e-+Li+=LiMnO2.
(6)已知:25℃时,HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,该反应的化学方程式为NaCN+H2S=HCN+NaHS.

已知:I.矿石中所有金属元素在滤液中均以离子形式存在.
Ⅱ.各种金属离子完全沉淀的pH如表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式3MnO2+2FeS+6H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$3MnSO4+Fe2(SO4)3+2S+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是Cu、Cd.
(3)步骤③与MnO2发生氧化还原反应的离子方程式MnO2+2Fe2++4H+=2Fe3++Mn 2++2H2O,物质X可以是BD(用字母表示.
A.Cu2(OH)2CO3 B.MnCO3 C.MgO D.Zn(OH)2
(4)流程中可以循环利用的物质是H2SO4(填化学式).
(5)MnO2与Li构成LiMnO2,该电池反应原理如图2所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
①外电路中的电子移动方向是由a极流向b极(填字母).
②写出该锂离子电池的正极电极反应式MnMnO2+e-+Li+=LiMnO2.
(6)已知:25℃时,HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,该反应的化学方程式为NaCN+H2S=HCN+NaHS.
15.混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示:
其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液.关于镍氢电池,下列说法不正确的是( )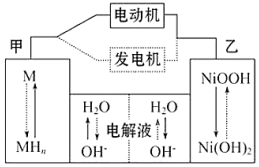
其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液.关于镍氢电池,下列说法不正确的是( )

| A. | 充电时,阴极附近pH降低 | |
| B. | 电动机工作时溶液中OH-向甲移动 | |
| C. | 放电时正极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| D. | 电极总反应式为:MH+NiOOH$?_{充电}^{放电}$M+Ni(OH)2 |
12.短周期元素X、Y、Z、W、M的原子序数依次增大,且原子最外层电子数之和为18,X与Y是组成化合物种类最多的元素,W是地壳中含量最高的元素.下列说法正确的是( )
| A. | 原子半径大小顺序:r(Y)>r(Z )>r(W)>r(M) | |
| B. | Z的气态氢化物比W的气态氢化物更稳定 | |
| C. | 分子式为Y5X12的物质只有3种 | |
| D. | 由三种元素X、Z、W形成的化合物中只有共价键而无离子键 |
19.下列关于有机化合物的说法正确的是( )
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物数目不相同 | |
| B. | 乙烷,苯,葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 与环己醇(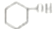 )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) |
16.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 在含A13+总数为NA的A1C13溶液中,C1-总数为3NA | |
| B. | 标准状况下,5.6L CO2中含有的共用电子对数为0.5NA | |
| C. | Na2O2与足量的CO2反应生成0.1mol O2,转移的电子数为0.2NA | |
| D. | 常温下,56g铁片投入足量浓H2SO4中,充分反应,生成NA个SO2分子 |
17.下列有关实验操作设计、现象记录、结论解释都正确的是( )
| 实验操作设计 | 现象记录 | 结论解释 | |
| A | 醋酸加入到碳酸钠固体中,将产生的气体通入C6H5ONa 溶液中 | 溶液变浑浊 | 酸性:CH3COOH>H2CO3>C6H5OH |
| B | CH3CH2Br 与NaOH 乙醇溶液共热产生的气体通入溴水中 | 溶液褪色 | 产生了乙烯 |
| C | 向某氯化亚铁溶液中加入加入Na2O2 粉末 | 出现红褐色沉淀 | 加入 Na2O2 粉末前,原氯化亚铁溶液已经变质 |
| D | 向紫色石蕊试液中持续长时 间通人氯气 | 溶液先变红,最后变为无色 | 氯气有漂白性 |
| A. | A | B. | B | C. | C | D. | D |