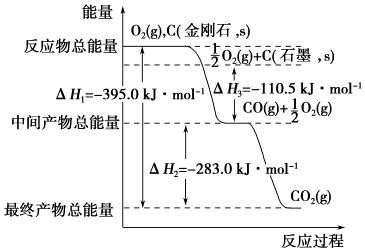
题目内容
12.下列说法正确的是( )| A. | 因SiO2不溶于水,故H2SiO3不是SiO2对应的酸,或者说SiO2不是H2SiO3的酸酐 | |
| B. | CO2通入Na2SiO3溶液中可以得到硅酸 | |
| C. | 因为高温时SiO2与Na2CO3反应生成CO2,故硅酸的酸性比碳酸强 | |
| D. | 硅的性质稳定,所以在自然界中可以以游离态存在 |
分析 A.二氧化硅不溶于水,但二氧化硅是硅酸的酸酐;
B.碳酸酸性强于硅酸,通入水玻璃中得到硅酸沉淀;
C.常温下,水溶液中强酸能制取弱酸;
D.自然界中没有游离态的硅存在.
解答 解:A.含氧酸的分子中,氢、氧原子以水分子的组成比失去后,形成的氧化物叫做该酸的酸酐,所以硅酸(H2SiO3)的酸酐是二氧化硅(SiO2),故A错误;
B.根据强酸制弱酸,二氧化碳通入水玻璃中发生Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓,故B正确;
C.高温下SiO2能与Na2CO3固体反应生成Na2SiO3和CO2,不是在常温下进行,且不是在水溶液中进行,不能说明硅酸的酸性强于碳酸,故C错误;
D.硅在自然界中以化合态形式存在,故D错误;
故选B.
点评 本题主要考查硅及其化合物的性质与应用,熟悉物质的性质是解题关键,注意C常温下,水溶液中强酸能制取弱酸,为易错点,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
3.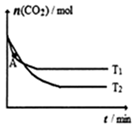 容积固定的密闭容器中,充入一定体积的CO2和H2,发生反应:CO2(g)+3H2(g)?CH3OH (g)+H2O(g).测得不同温度下CO2的物质的量随时间变化如图.下列说法正确的是( )
容积固定的密闭容器中,充入一定体积的CO2和H2,发生反应:CO2(g)+3H2(g)?CH3OH (g)+H2O(g).测得不同温度下CO2的物质的量随时间变化如图.下列说法正确的是( )
 容积固定的密闭容器中,充入一定体积的CO2和H2,发生反应:CO2(g)+3H2(g)?CH3OH (g)+H2O(g).测得不同温度下CO2的物质的量随时间变化如图.下列说法正确的是( )
容积固定的密闭容器中,充入一定体积的CO2和H2,发生反应:CO2(g)+3H2(g)?CH3OH (g)+H2O(g).测得不同温度下CO2的物质的量随时间变化如图.下列说法正确的是( )| A. | 该反应为吸热反应 | |
| B. | T1、T2对应的平衡常数K1>K2 | |
| C. | T1时,图中A点的正反应速率小于逆反应速率 | |
| D. | T2时,若上述反应在压强恒定的密闭容器中进行,达平衡的时间变短 |
20.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物叙述正确的是( )
| A. | 一个D216O分子所含的中子数为8 | |
| B. | NH4Cl是只含非金属元素的共价化合物 | |
| C. | HCl的电子式为 | |
| D. | H2S不如HF稳定性强 |
7. 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为1g;
⑥正极的电极反应式为Zn-2e-═Zn2+.
 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( ) ①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为1g;
⑥正极的电极反应式为Zn-2e-═Zn2+.
| A. | ①②③ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ②③④ |
17.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
| A. | H2O2分子中只存在极性键 | B. | NH3的结构式为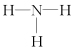 | ||
| C. | HCl的电子式为 | D. | 每个水分子内含有2个氢键 |
4.下列关于离子反应的说法正确的是( )
| A. | NH4HSO3与NaOH等物质的量反应:NH4++HSO3-+2OH-═NH3•H2O+SO32- | |
| B. | 铜与浓硝酸反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 1.0 mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 过量SO2通入次氯酸钠溶液:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
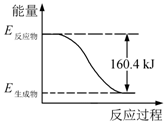 2016年9月我国成功利用大功率运载火箭发射“天宫二号”空间实验室.火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),如图是一定量肼完全燃烧生成氮气和1mol气态水过程中的能量变化图.
2016年9月我国成功利用大功率运载火箭发射“天宫二号”空间实验室.火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),如图是一定量肼完全燃烧生成氮气和1mol气态水过程中的能量变化图. 反应类型加聚反应
反应类型加聚反应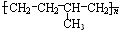 单体结构简式为CH2=CH2和CH3-CH=CH2.
单体结构简式为CH2=CH2和CH3-CH=CH2.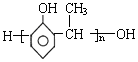 单体结构简式为
单体结构简式为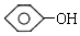 和CH3CHO.
和CH3CHO.