题目内容
1.(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
探究浓度对化学反应速率的影响,应选择①②或③④(填实验编号);
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是5H2O+S2O32-+4Cl2=2SO42-+8Cl-+10H+.
分析 (1)探究温度对化学反应速率的影响,应选择浓度相同条件下的实验;要探究浓度对化学反应速率的影响,应选择温度相同条件下的实验;
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子,氯气有强氧化性,将S2O32-氧化为2SO42-,根据这个关系写出离子方程式.
解答 解:(1)探究温度对化学反应速率的影响,应选择温度不两同,浓度相同条件下的实验,所以应选择①④;要探究浓度对化学反应速率的影响,应选择浓度不同,温度相同条件下的实验,所以应选择①②或③④;
故答案为:①④;①②或③④;
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子,S2O32-中硫的化合价从+2价升高到+6价,1个S2O32-升高8价,得到2个SO42-,4个Cl2化合价降低8价,所以是4个Cl2将1个S2O32-氧化为2SO42-,根据这个关系写出离子方程式是:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,
故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
点评 本题探究影响化学反应速率的因素,注意控制变量法讨论,第(2)题离子方程式的书写与量有关,用氧化还原反应中得失电子相等,化合价升降总数相等写出离子方程式.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
13.由A、B、C、D四种金属按下表中装置进行实验.
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu,溶液中Cu2+向C极移动(填“B”或“C”).
(3)当装置丙中产生3.36L(标准状况)气体时,电路中转移的电子数目为0.3NA.
(4)四种金属活动性由强到弱的顺序是D>A>B>C.
| 装置 | 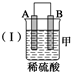 | 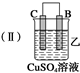 | 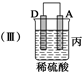 |
| 现象 | 二价金属A 不断溶解 | C的质 量增加 | A上有气 体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu,溶液中Cu2+向C极移动(填“B”或“C”).
(3)当装置丙中产生3.36L(标准状况)气体时,电路中转移的电子数目为0.3NA.
(4)四种金属活动性由强到弱的顺序是D>A>B>C.
14.下列说法正确的是( )
| A. | 离子键是指阴阳离子间的静电引力 | |
| B. | 离子化合物是指只含有离子键的化合物 | |
| C. | 升高温度只能使吸热反应的速率增大,不能使放热反应的速率增大 | |
| D. | 粉碎固体反应物可以增大反应速率 |
18.能够说明氨水是弱碱的事实是( )
| A. | 氨水具有挥发性 | |
| B. | 1mol/L氨水溶液的pH=10 | |
| C. | 1mol/LNH4Cl溶液的pH=5 | |
| D. | 氨水与AlCl3溶液反应生成Al(OH)3沉淀 |
6.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生的反应有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑.(离子方程式)
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了原电池,写出该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有BC.
A.将稀硫酸换成浓硫酸 B.适当升高温度
C.用锌粉代替锌粒 D.增加上述稀硫酸的用量
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)上述实验中发生的反应有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑.(离子方程式)
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了原电池,写出该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有BC.
A.将稀硫酸换成浓硫酸 B.适当升高温度
C.用锌粉代替锌粒 D.增加上述稀硫酸的用量
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
 ,反应的化学方程式为
,反应的化学方程式为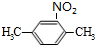 +H2O.
+H2O. 某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: