题目内容
18.能够说明氨水是弱碱的事实是( )| A. | 氨水具有挥发性 | |
| B. | 1mol/L氨水溶液的pH=10 | |
| C. | 1mol/LNH4Cl溶液的pH=5 | |
| D. | 氨水与AlCl3溶液反应生成Al(OH)3沉淀 |
分析 只要说明一水合氨在水溶液中部分电离就能证明一水合氨是弱碱,可以根据一定浓度溶液的pH、强酸铵盐的酸碱性等分析判断.
解答 解:A.氨水具有挥发性,属于氨水的物理性质,与电解质强弱无关,不能说明一水合氨部分电离,所以不能证明氨水是弱碱,故A错误;
B.如果NH3•H2O是强碱,则能完全电离,1 mol/L氨水中OH-浓度应为1mol/L,其pH应为14,但现在其pH=10,即溶液中OH-浓度为10-4mol/L,即NH3•H2O不能完全电离,是弱碱,故B正确;
C.1mol/L的氯化铵溶液pH=5,溶液呈酸性,说明氯化铵是强酸弱碱盐,则说明一水合氨是弱电解质,故C正确;
D.氨水与AlCl3溶液反应生成Al(OH)3沉淀.该反应为复分解反应,无论是强碱还是弱碱均有该反应.不能说明氨水是弱碱.故D错误,
故选BC.
点评 本题考查弱电解质的判断,明确强弱电解质的根本区别是解本题关键,注意不能根据溶解性强弱、溶液导电能力大小判断电解质强弱,为易错点.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
13.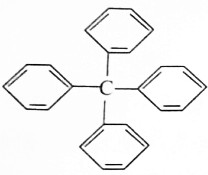 甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:
甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:
对该分子的下列叙述,不正确的是( )
 甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:
甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:对该分子的下列叙述,不正确的是( )
| A. | 分子式为C25H20 | |
| B. | 所有碳原子都在同一平面上 | |
| C. | 此物质属于芳香烃类物质 | |
| D. | 该物质中既含有极性键又含有非极性键 |
1.(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):
其他条件不变时:探究温度对化学反应速率的影响,应选择①④(填实验编号);
探究浓度对化学反应速率的影响,应选择①②或③④(填实验编号);
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是5H2O+S2O32-+4Cl2=2SO42-+8Cl-+10H+.
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
探究浓度对化学反应速率的影响,应选择①②或③④(填实验编号);
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是5H2O+S2O32-+4Cl2=2SO42-+8Cl-+10H+.
8.(1)已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验一如下(所取溶液体积均为10mL):
其他条件不变时:探究温度对化学反应速率的影响,应选择实验①⑤或②④(填实验编号);
若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究比较改变不同反应物的浓度对反应速率的影响对化学反应速率的影响.
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为$\frac{3a}{5V}$ mol/(L•min).
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大.
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是催化剂(或硫酸锰或Mn2+的催化作用)的影响.
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B(填字母序号).
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究比较改变不同反应物的浓度对反应速率的影响对化学反应速率的影响.
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为$\frac{3a}{5V}$ mol/(L•min).
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大.
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是催化剂(或硫酸锰或Mn2+的催化作用)的影响.
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B(填字母序号).
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
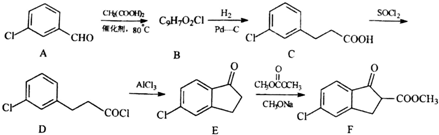
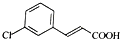 ,由D→E的反应类型是取代反应.
,由D→E的反应类型是取代反应.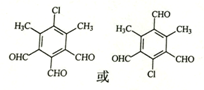 .
.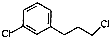 )为原料制备化合物E(
)为原料制备化合物E(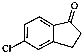 )的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
)的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
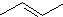 某有机物X的键线式为
某有机物X的键线式为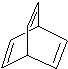 .
.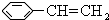 ,
, .
.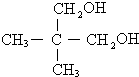 .
.