题目内容
11.分类是重要的科学研究方法,下列物质分类错误的是( )| A. | 单质:金刚石、白磷 | B. | 酸性氧化物:SO3、CO2、NO | ||
| C. | 混合物:铝热剂、矿泉水、焦炉气 | D. | 同素异形体:C60、C70、金刚石 |
分析 A.同种元素组成的纯净物为单质;
B.酸性氧化物:能与水作用生成相应价态的酸,或与碱作用生成盐和水,或与碱性氧化物反应生成盐的氧化物;
C.混合物:由两种或多种物质混合而成的物质;
D.相同元素组成,不同形态的单质互为同素异形体.
解答 解:A.金刚石、白磷都是同种元素组成的纯净物为单质,故A正确;
B.CO2、SO2属于酸性氧化物:NO为不成盐氧化物,故B错误;
C.铝热剂是铝粉和三氧化二铁粉末的混合物、矿泉水是水与盐类的混合物、焦炉气主要由氢气和甲烷构成,故C正确;
D.C60、C70、金刚石是由碳元素形成的不同单质,互为同素异形体,故D正确;
故选B.
点评 本题考查电解质、酸性氧化物、混合物、同素异形体的概念,难度不大.要注意基础知识的积累.

练习册系列答案
相关题目
2.化合物Ⅲ是合成中药黄芩中的主要活性成分的中间体,合成方法如下:
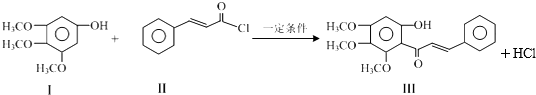
下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | I的分子式为C9H10O4 | |
| B. | II中所有原子有可能均共面 | |
| C. | 可用FeCl3溶液鉴别有机物I和III | |
| D. | 1 mol产物III与足量溴水反应,消耗Br2的物质的量为1.5 mol |
19.取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
| A. | 0.01 mol/L | B. | 0.07 mol/L | C. | 0.05 mol/L | D. | 0.50 mol/L |
16.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 18g H2O在标准状况下的体积是22.4L | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 通常状况下,NA个CO2分子占有的体积为22.4L |
3.下列叙述正确的是( )
| A. | 1molH2O的质量为18g/mol | B. | CH4的摩尔质量为16g | ||
| C. | 3.01×1023个SO2分子的质量为32g | D. | 0.05mol SO2的体积是1.12L |
20.下列仪器可以直接加热的是( )
| A. | 烧杯 | B. | 烧瓶 | C. | 锥形瓶 | D. | 试管 |
1.下列说法正确的是( )
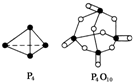
| A. | 124g P4含有的P-P键数为4NA(设NA表示阿伏伽德罗常数的值) | |
| B. | Be和NaOH溶液反应的离子方程式是:2Be+2OH -+2H2O=2BeO2-+3H2↑ | |
| C. | 在NaCl溶液中加入AgNO3溶液,生成白色沉淀;再加入氨水,沉淀消失,沉淀消失发生的离子方程式是: AgCl+2NH3•H2O=[Ag(NH3)2]++Cl-+2H2O | |
| D. | 0.1mol/L的Fe3+溶液中,能大量共存的离子有Cl-、SO42-、SCN- |
 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.