题目内容
7.处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,A处于B的右边(左或右);B的原子半径比A大;若B的最外层有x个电子,则A最外层有x+1个电子(用含x的式子表示).分析 同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,可知金属性B>A,同周期从左向右金属性减弱、原子半径减小、原子序数增大,以此来解答.
解答 解:同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,可知金属性B>A,同周期从左向右金属性减弱、原子半径减小、原子序数增大,则A处于B的右边,B的原子半径比A大,若B的最外层有x个电子,则A最外层有x+1个电子,
故答案为:右;大;x+1.
点评 本题考查元素周期表的结构及应用,为高频考点,把握金属性比较方法及元素周期律为解答的关键,侧重分析与应用能力的考查,注意同周期元素的性质,题目难度不大.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
3.下列电池工作时,负极上有H2参与反应的是( )
| A. |  氢燃料电池 | B. |  锌锰碱性电池 | C. |  铅蓄电池 | D. |  银锌纽扣电池 |
15.如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )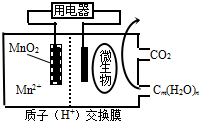

| A. | 放电过程中,H+从正极区移向负极区 | |
| B. | 分子组成为Cm(H2O)n的物质一定是糖类 | |
| C. | 微生物所在电极区放电时发生还原反应 | |
| D. | 左边电极反应式为:MnO2+4H++2e-=Mn2++2H2O |
2.化合物Ⅲ是合成中药黄芩中的主要活性成分的中间体,合成方法如下:
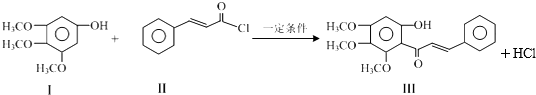
下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | I的分子式为C9H10O4 | |
| B. | II中所有原子有可能均共面 | |
| C. | 可用FeCl3溶液鉴别有机物I和III | |
| D. | 1 mol产物III与足量溴水反应,消耗Br2的物质的量为1.5 mol |
12.离子反应方程式H++OH-=H2O,可表示的化学反应是( )
| A. | Cu(OH)2和稀H2SO4反应 | B. | HNO3和Mg(OH)2反应 | ||
| C. | Ba(OH)2溶液和HCl溶液混合 | D. | NaOH和CH3COOH反应 |
19.取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
| A. | 0.01 mol/L | B. | 0.07 mol/L | C. | 0.05 mol/L | D. | 0.50 mol/L |
16.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 18g H2O在标准状况下的体积是22.4L | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 通常状况下,NA个CO2分子占有的体积为22.4L |
17.在相同温度下,0.01mol•L-1NaOH溶液和0.01mol•L-1的盐酸相比,下列说法正确的是( )
| A. | 两溶液中由水电离出c(H+)都是1.0×10-12 mol•L-1 | |
| B. | NaOH溶液和盐酸中由水电离出c(OH-)分别为1.0×10-2mol•L-1、1.0×10-12 mol•L-1 | |
| C. | 两溶液中由水电离出的c(H+)相等 | |
| D. | 两者都促进了水的电离 |
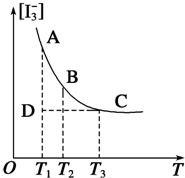 实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq).上述平衡体系中,I3-的物质的量浓度[I3-]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).
实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq).上述平衡体系中,I3-的物质的量浓度[I3-]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).