题目内容
19.现有100mL1.0mol/L的Na2SO4溶液,计算:(1)所含Na2SO4的物质的量为多少摩尔?
(2)所含Na2SO4的质量为多少克?
若取出上述Na2SO4溶液10mL,加水稀释至100mL后.求:
(3)稀释后的溶液中含Na2SO4的物质的量为多少摩尔?
(4)稀释后的溶液中Na+的物质的量浓度为多少?
分析 (1)根据n=cV计算Na2SO4的物质的量;
(2)根据m=nM计算Na2SO4的质量;根据稀释定律计算稀释后溶液物质的量浓度;
(3)根据n=cV计算稀释后溶液中Na2SO4的物质的量;
(4)溶液中Na+的物质的量浓度为硫酸钠的2倍.
解答 解:(1)含有Na2SO4的物质的量为0.1L×1mol/L=0.1mol,
答:Na2SO4的物质的量为0.1mol;
(2)含有Na2SO4的质量为0.1mol×142g/mol=14.2g;
根据稀释定律,稀释后溶液物质的量浓度为$\frac{0.01L×1mol/L}{0.1L}$=0.1mol/L,
答:含有Na2SO4的质量为14.2g,稀释后溶液物质的量浓度为0.1mol/L;
(3)稀释后溶液中Na2SO4的物质的量为0.1L×0.1mol/L=0.01mol,
答:稀释后溶液中Na2SO4的物质的量为0.01mol;
(4)稀释后溶液中Na+的物质的量浓度为0.1mol/L×2=0.2mol/L,
答:稀释后溶液中Na+的物质的量浓度为0.2mol/L.
点评 本题考查物质的量浓度计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
9.下列物质属于酸性氧化物的是( )
| A. | CO | B. | K2SO4 | C. | SO2 | D. | Na20 |
7.下列说法中正确的是( )
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| C. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 | |
| D. | Na2O2晶体中既含有离子键又含有共价键 |
14.现有100mLNaCl和Na2SO4的混合溶液.经测定含有0.1mol SO42-,Na+的物质的量浓度为5mol/L.则Cl-的物质的量浓度为( )
| A. | 2mol/L | B. | 3mol/L | C. | 4mol/L | D. | 5mol/L |
4.在体积为2L的密闭容器中通入0.4molSO2和0.2molO2发生反应2SO2+O2?2SO3,下列叙述正确的是( )
| A. | 若反应中加入的是18O2,达到平衡后SO2中不可能含有18O | |
| B. | 平衡时,SO3的浓度可能为0.2mol/L | |
| C. | 当不再生成SO3时反应达到平衡 | |
| D. | 温度不变,改变SO2和O2的加入量,达到平衡时$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})(C{O}_{2})}$不变 |
8.下列叙述中正确的是( )
| A. | 含最高价元素的化合物,一定具有强氧化性 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 失电子多的还原剂,还原性就强 | |
| D. | 化学反应中,某元素由化合态变为游离态,此元素可能被氧化,也可能被还原 |
11.下列溶液中的离子一定能大量共存的是( )
| A. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | 室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+、NO3-、K+、ClO- | |
| C. | 能使酚酞变红色的溶液中:Na+、K+、AlO2-、CO32- | |
| D. | 在c(HCO3-)=0.1 mol•L-1的溶液中:NH4+、AlO2-、Cl-、NO3- |
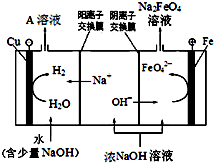 铁及其化合物在生产生活中具有重要的作用.
铁及其化合物在生产生活中具有重要的作用.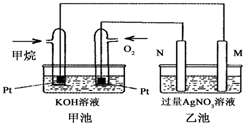 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题: