题目内容
14.现有100mLNaCl和Na2SO4的混合溶液.经测定含有0.1mol SO42-,Na+的物质的量浓度为5mol/L.则Cl-的物质的量浓度为( )| A. | 2mol/L | B. | 3mol/L | C. | 4mol/L | D. | 5mol/L |
分析 溶液呈电中性,根据电荷守恒得c(Na+)=c(Cl-)+2c(SO42-).
解答 解:溶液中c(SO42-)=$\frac{0.1mol}{0.1L}$=1mol/L,溶液呈电中性,根据电荷守恒得c(Na+)=c(Cl-)+2c(SO42-),则:5mol/L=c(Cl-)+2×1mol/L,解得c(Cl-)=3mol/L,
故选:B.
点评 本题考查物质的量浓度有关计算,侧重考查学生分析计算能力,注意电荷守恒的灵活运用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L 和2mol/L,取10mL此混合酸,向其中加入足量的铜粉,待反应结束后,可产生标准状况下的气体为( )
| A. | 2.24 L | B. | 1.12 L | C. | 0.672 L | D. | 0.448 L |
5.关于下列装置的说法中正确的是( )
| A. | 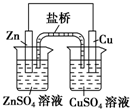 装置中,盐桥(含琼脂的饱和KCl溶液)中的K+移向ZnSO4溶液 | |
| B. | 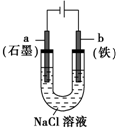 装置通电一段时间后溶液中有红褐色物质产生 | |
| C. | 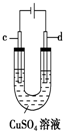 用装置精炼铜时,c极为粗铜 | |
| D. | 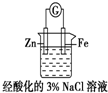 装置中电子由Zn电极沿外电路流向Fe电极,装置中有Fe2+生成 |
2.反应4NH3(g)+5O2═4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此段时间内,该反应的速率v可表示为( )
| A. | v(NH3)=0.010mol/(L.s) | B. | v(O2)=0.010mol/(L.s) | ||
| C. | v(NO)=0.0010mol/(L.s) | D. | v(H2O)=0.045mol/(L.s) |
6. 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )
 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )| A. | 0~4 min时,A的平均反应速率为0.1 mol/(L•min) | |
| B. | 该反应是一个吸热反应 | |
| C. | 平衡后升高温度,K值增大 | |
| D. | 该反应的平衡常数表达式为:K=$\frac{c(C)}{{c}^{2}(A)c(B)}$ |
3.加入适量的硫酸,可使下列的离子浓度减小的是( )
| A. | Na+ | B. | H+ | C. | CO32- | D. | Cl- |
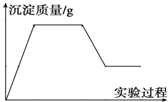 有一包白色固体物质,可能含有CuSO4、K2SO4、Na2CO3、Ca (NO3)2、KCl 中的一种或几种.将该白色固体少量溶于水中,得到无色透明溶液,取100mL该溶液先滴加足量硝酸钡溶液,再滴加足量稀硝酸,实验过程中沉淀质量的变化如图所示:
有一包白色固体物质,可能含有CuSO4、K2SO4、Na2CO3、Ca (NO3)2、KCl 中的一种或几种.将该白色固体少量溶于水中,得到无色透明溶液,取100mL该溶液先滴加足量硝酸钡溶液,再滴加足量稀硝酸,实验过程中沉淀质量的变化如图所示: