题目内容
14.短周期主族元素A.B.C.D.E,原子序数依次增大,A元素的单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的.(1)已知相关物质之间存在如下变化:
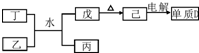
①丁与乙和水反应生成戊和丙的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,由物质己电解得到单质D的化学方程式为2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;
②0.1mol/L的丙溶液中所含离子浓度由大到小排列顺序为C(NO3-)>C(NH4+)>C(H+)>C(OH-);;常温下,为使丙溶液中由丙电离的阴.阳离子浓度相等,应向溶液中加入一定量的乙的水溶液至中性.
(2)已知E 及其化合物有以下变化:
 ,
,写出单质E与化合物Z在一定条件下反应生成X和水的化学方程式S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O;由A.B.C.D.E 5种元素中的两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为H2O2或N2H4或C2H6等(任写一个即可).
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的C的含氧酸盐的化学式是NaNO2.
分析 短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常压下是最轻的气体,则A为H元素,B元素所形成化合物种类最多,则B为C元素,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙,丙为铵盐,故C为N元素,甲为HNO3,乙为NH3,丙为NH4NO3,D元素的离子半径是同周期元素形成的简单离子中最小的,D的原子序数比N元素大,故D处于第三周期,则D为Al元素.
(1)①己电解生成金属Al,故己为Al2O3,由转化关系可知,戊为Al(OH)3,丁为Al(NO3)3;
②NH4NO3溶液中NH4+水解,溶液呈酸性;
常温下,为使丙溶液硝酸铵溶液中电离的阴、阳离子浓度相等,即溶液中c(NO3-)═c(NH4+),根据溶液中电荷守恒,则溶液中c(OH-)═c(H+),溶液呈中性;
(2)E元素原子序数大于Al,处于第三周期,由E$\stackrel{O_{2}}{→}$X$\stackrel{O_{2}}{→}$Y,E可能为S,X为SO2,Y为SO3,由Y$\stackrel{水}{→}$Z,Z为H2SO4,硫酸与硫反应可以生成二氧化硫,符合转化关系;
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,该无色气体为NO.相同体积下体积之比等于物质的量之比,反应中只有N元素与O元素的化合价发生变化,利用电子转移守恒计算N元素在酸根中的化合价,判断酸根书写盐的化学式.
解答 解:短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常压下是最轻的气体,则A为H元素,B元素所形成化合物种类最多,则B为C元素,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙,丙为铵盐,故C为N元素,甲为HNO3,乙为NH3,丙为NH4NO3,D元素的离子半径是同周期元素形成的简单离子中最小的,D的原子序数比N元素大,故D处于第三周期,则D为Al元素.
(1)①己电解生成金属Al,故己为Al2O3,由转化关系可知,戊为Al(OH)3,丁为Al(NO3)3,丁与乙和水反应生成戊和丙的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,由物质己电解得到单质D的化学方程式为:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;
②NH4NO3溶液中NH4+水解,溶液呈酸性,溶液中离子浓度大小为:C(NO3-)>C(NH4+)>C(H+)>C(OH-);
常温下,为使丙溶液硝酸铵溶液中电离的阴、阳离子浓度相等,即溶液中c(NO3-)═c(NH4+),根据溶液中电荷守恒,则溶液中c(OH-)═c(H+),溶液呈中性,
故答案为:C(NO3-)>C(NH4+)>C(H+)>C(OH-);中性;
(2)E元素原子序数大于Al,处于第三周期,由E$\stackrel{O_{2}}{→}$X$\stackrel{O_{2}}{→}$Y,E可能为S,X为SO2,Y为SO3,由Y$\stackrel{水}{→}$Z,Z为H2SO4,硫酸与硫反应可以生成二氧化硫,符合转化关系,
单质S与H2SO4在一定条件下反应生成SO2和水,反应的化学方程式为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O;由H、C、N、Al、S 5种元素中的两种元素,形成既含极性键又含非极性键的18电子的分子,该分子为H2O2、N2H4、C2H6等;
故答案为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O;H2O2或N2H4或C2H6等;
(3)该无色气体是NO,2LNO与0.5L的氧气混合,混合气体被足量的NaOH溶液完全吸收后没有气体残留,反应中只有N元素与O元素的化合价发生变化,令N元素在酸根中的化合价为a,根据电子转移守恒有2×(a-2)=0.5×4,解得a=3,即酸根中N元素的化合价为+3,故生成NaNO2;
故答案为:NaNO2.
点评 主要以“无机框图题”的形式考查元素单质及其化合物的性质,涉及常用化学用语与氧化还原计算等,难度中等,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力.

| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe=2 Fe2+ | |
| D. | NaHCO3溶液与盐酸反应:HCO3-+H+=CO2↑+H2O |
| A. | 将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)═c(HC2O4-)+c(H2C2O4) | |
| B. | 0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH${\;}_{4}^{+}$)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/L的CH3COOH溶液加水稀释,$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$的比值将增大 | |
| D. | 0.1mol/LCH3COONa溶液与0.15mol/LHCl等体积混合:c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-) |
| A. | $\frac{18}{{N}_{A}}$ | B. | $\frac{18}{{N}_{A}}$g•mol-1 | C. | 18NA g | D. | $\frac{18}{{N}_{A}}$g |
| A. | 4.4 g | B. | 2.2 g | C. | 5.5 g | D. | 8.2 g |
| A. | 22.4g | B. | 11.2g | C. | 20.4g | D. | 5.6g |
| A. | 属于电解质的有3种 | B. | 属于纯净物的有6种 | ||
| C. | 属于非电解质的有3种 | D. | 上述状态下能导电的有5种 |
| A. | 用分液法可分离植物油和水 | |
| B. | 用过滤法可出去食盐中混有的Fe(OH)3胶体 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 用盐酸可除去Mg中混有的Al |
 氯酸钠(NaClO3)是无机盐工业的重要产品之一.
氯酸钠(NaClO3)是无机盐工业的重要产品之一.