题目内容
7.下列离子方程式书写正确的是( )| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe=2 Fe2+ | |
| D. | NaHCO3溶液与盐酸反应:HCO3-+H+=CO2↑+H2O |
分析 A.电荷不守恒;
B.不符合反应客观事实;
C.电荷不守恒;
D.二者反应生成氯化钠、二氧化碳和水.
解答 解:A.向氯化亚铁溶液中通入氯气,离子方程式:2Fe2++Cl2=2Fe3++2Cl-,故A错误;
B.铁钉放入硫酸铜溶液中,离子方程式:Fe+Cu2+=Fe2++Cu,故B错误;
C.三氯化铁溶液中加入铁粉,离子方程式:2Fe3++Fe=3 Fe2+,故C错误;
D.NaHCO3溶液与盐酸反应,离子方程式:HCO3-+H+=CO2↑+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应应遵循客观事实、遵循原子个数、电荷守恒规律,题目难度不大.

 阅读快车系列答案
阅读快车系列答案(本题满分18分)二甲 醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
编号 | 热化学方程式 | 化学平衡常数 |
① | CO(g)+2H2(g) | K1 |
② | 2CH3OH(g) | K2 |
③ | CO(g)+H2O(g) | K3 |
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H﹣H | C﹣O | C=O | H﹣O | C﹣H |
E/(kJ.mol﹣1) | 436 | 343 | 1076 | 465 | 413 |
由上述数据计算△H1= ;
(2)该工艺的总反应为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
(3)下列措施中,能提高CH3OCH3产率的有 ;
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是 ;
(5)以n(H2)/n(CO)=2 通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;
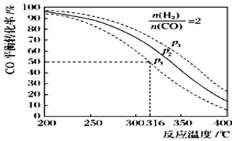
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时n(H2)/n(CO)=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K= .
| A. | 2NO2(g)?N2O4(g)(正反应为放热反应) | |
| B. | 2SO3(g)?2SO2(g)+O2(g)(正反应为吸热反应) | |
| C. | H2(g)+I2(g)?2HI (g)(正反应为放热反应) | |
| D. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g) (正反应为放热反应) |
| 原物质 | 所含杂质 | 除杂试剂 | 主要操作方法 | |
| A | HNO3溶液 | H2SO4 | BaCl2溶液 | 过滤 |
| B | CO2 | SO2 | 酸性KMnO4溶液、浓硫酸 | 洗气、干燥 |
| C | SiO2 | Al2O3 | 稀盐酸 | 过滤 |
| D | C2H5OH | CH3COOH | CaO | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
 2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是
2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是
 极
极 2NH3(g) △H<0,下列研究目的和示意图相符的是
2NH3(g) △H<0,下列研究目的和示意图相符的是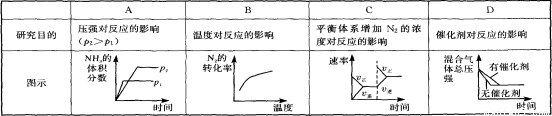
 ,
,