题目内容
7. 氯酸钠(NaClO3)是无机盐工业的重要产品之一.
氯酸钠(NaClO3)是无机盐工业的重要产品之一.(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的Na2CO3(填试剂化学式),过滤后即可得到.
(2)实验室制取氯酸钠可通过如下反应:
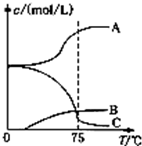
3C12+6NaOH$\frac{\underline{\;△\;}}{\;}$5NaC1+NaC1O3+3H2O先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子
是ClO-.
(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠.则反应化学方程式为:NaC1+3H2O$\frac{\underline{\;通电\;}}{\;}$NaC1O3+3H2↑.
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液.
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L
(NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min.
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,消耗体积15.62mL.
步骤4:重复上述步骤2、3操作2-3次.
步骤5:数据处理与计算.
①步骤2中反应的离子方程式为ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;静置10min的目的是使溶液中C1O3-与Fe2+反应充分完全.
②步骤3中K2Cr2O7标准溶液应盛放在酸式滴定管(填仪器名称)中.
③为精确测定样品中C1O3-的质量分数,步骤4操作为重复上述步骤2、3操作2-3次.
(5)在上述操作无误的情况下,所测定的结果偏高,其可能的原因的原因是溶液中的Fe2+被空气中的氧气氧化.
分析 (1)石灰乳与氯气反应生成氯化钙和氯酸钙,除去氯化钙后,可加入碳酸钠溶液,以生成碳酸钙沉淀,以此得到氯酸钠;
(2)氯气与氢氧化钠反应温度低时生成NaClO,温度高时生成NaC1O3;
(3)采用无隔膜电解饱和食盐水法生产氯酸钠,同时生成氢气;
(4)①酸性条件下,亚铁离子被ClO3-氧化为铁离子,自身被还原为氯离子;静置10min可以使反应进行完全;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管;
③滴定实验操作一般重复2-3次;
(5)如果溶液中的Fe2+被空气中的氧气,在滴定时消耗的(NH4)2Fe(SO4)2溶液会偏多.
解答 解:热的石灰乳通入氯气,反应的方程式为:2Cl2+2Ca(OH)2$\frac{\underline{\;加热\;}}{\;}$CaCl2+Ca(ClO)2+2H2O,除去CaCl2后主要成分为Ca(ClO)2,要加入钠盐得到NaClO3,应加入Na2CO3,发生复分解反应生成碳酸钙沉淀,
故答案为:Na2CO3;
(2)氯气与氢氧化钠反应温度低时生成NaClO,温度高时生成NaC1O3,图中C的浓度随着温度的升高而减小,所以C代表ClO-;
故答案为:ClO-;
(3)采用无隔膜电解饱和食盐水法生产氯酸钠,同时生成氢气,其反应的方程式为:NaC1+3H2O$\frac{\underline{\;通电\;}}{\;}$NaC1O3+3H2↑;
故答案为:NaC1+3H2O$\frac{\underline{\;通电\;}}{\;}$NaC1O3+3H2↑;
(4)①酸性条件下,亚铁离子被ClO3-氧化为铁离子,自身被还原为氯离子,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;静置10min可以使亚铁离子和ClO3-充分反应;
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;使溶液中C1O3-与Fe2+反应充分完全;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以应该用酸式滴定管盛放;
故答案为:酸式滴定管;
③为精确测定样品中C1O3-的质量分数,滴定实验操作一般重复2-3次,即重复上述步骤2、3操作2-3次;
故答案为:重复上述步骤2、3操作2-3次;
(5)如果溶液中的Fe2+被空气中的氧气,则溶液中Fe2+的浓度会减小,在滴定时消耗的(NH4)2Fe(SO4)2溶液的体积会偏大,所以测定的结果偏高;
故答案为:溶液中的Fe2+被空气中的氧气氧化.
点评 本题以氯酸盐的制备为载体考查物质的分离、提纯以及含量的测定、氧化还原反应滴定法的应用等,侧重于学生的分析、实验能力的考查,注意把握物质的性质为解答该题的关键,题目难度中等.

| A. | 2NO2(g)?N2O4(g)(正反应为放热反应) | |
| B. | 2SO3(g)?2SO2(g)+O2(g)(正反应为吸热反应) | |
| C. | H2(g)+I2(g)?2HI (g)(正反应为放热反应) | |
| D. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g) (正反应为放热反应) |
| 原物质 | 所含杂质 | 除杂试剂 | 主要操作方法 | |
| A | HNO3溶液 | H2SO4 | BaCl2溶液 | 过滤 |
| B | CO2 | SO2 | 酸性KMnO4溶液、浓硫酸 | 洗气、干燥 |
| C | SiO2 | Al2O3 | 稀盐酸 | 过滤 |
| D | C2H5OH | CH3COOH | CaO | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
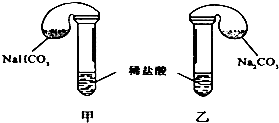 某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:
某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:(1)各组反应开始时,甲装置中的气球体积先变大,该装置中反应的离子方程式是HCO3-+H+═H2O+CO2↑.
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格.
| | 试剂用量 | 实验现象 (气球体积变化)) | 分析原因 |
| 第 ① 组 | 42 g NaHCO3 53 g Na2CO3 300mL4 mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42 g NaHCO3 53 g Na2CO3 300mL3 mol/L盐酸 |
| A. | Fe 和Zn | B. | Al和Cu | C. | Na和Mg | D. | Mg和Fe |
 2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是
2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是
 极
极
 ,
,