题目内容
2. 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )| A. | 电池工作时,正极反应式为O2+2H2O+4e-═4OH | |
| B. | 电解时,电子流动路径是负极→外电路→阴极→溶液→阳极→正极 | |
| C. | 试管中NaOH溶液用来吸收电解时产生的Cl2 | |
| D. | 当电池中消耗2.24L(标准情况下)H2时,b极周围会产生0.021mol气体 |
分析 A、氢氧燃料电池中,正极上放电的是氧气;
B、电子在导线中移动,不能在溶液中移动;
C、防止氯气污染空气;
D、燃料电池和电解池中转移的电子数是相等的.
解答 解:A、氢氧燃料电池中,正极上放电的是氧气,在酸性电解质环境下,电极反应式为:O2+4H++4e-═2H2O,故A错误;
B、电子在导线中移动,不能在溶液中移动,则电子流动路径是:负极-→外电路-→阴,阳极-→正极,故B错误;
C、防止氯气污染空气,用氢氧化钠溶液来吸收,故C正确;
D、燃料电池和电解池中转移的电子数是相等的,当电池中消耗2.24H2L,根据电极反应:H2→2H++2e-,所以转移电子0.2mol,b极的电极反应为:2H++2e-→H2,转移电子0.2mol,故D错误.
故选C.
点评 本题考查了原电池和电解池,明确原电池和电解池原理是解本题关键,知道离子的放电顺序,易错选项是B,注意电子不进入电解质溶液,溶液中阴阳离子定向移动而形成电流,难度不大.

练习册系列答案
相关题目
13.下列有关物质的性质与其应用相对应的是( )
| A. | 铝热反应可以快速制取单质铁,工业上常用此法冶炼铁 | |
| B. | NaHCO3能与碱反应,食品工业中用做焙制糕点的膨松剂 | |
| C. | K2FeO4具有强氧化性,其产物水解生成Fe(OH)3胶体,故可用于自来水消毒和净化 | |
| D. | SO2具有漂白性,可用于食品的消毒和漂白 |
10.化学与人类生活密切相关,下列与化学有关的说法不正确的是( )
| A. | 开发和推广新能源是实现低碳生活的唯一途径 | |
| B. | 化学药品NaH着火,不能用水或泡沫灭火器灭火 | |
| C. | 食品添加剂虽能改变食物味道等,但需限量使用 | |
| D. | 化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的元凶 |
17.已知:2Fe2++Cl2═2Fe3++2Cl-,下列叙述正确的是( )
| A. | 该反应属于置换反应 | |
| B. | 该反应属于离子反应 | |
| C. | 若有0.1mol氯气参与反应,则转移电子0.1mol | |
| D. | 该反应中Cl2既是氧化剂又是还原剂 |
11.下列有关物质应用的说法正确的是( )
| A. | MgCl2是强电解质,电解氯化镁溶液可以制得镁 | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 晶体硅可用作制造太阳能电池和光导纤维 | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
12.在一定温度下,将气体 X 和气体 Y 各 0.16mol 充入 10L 恒容密闭容器中,发生反应 X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
| t/min | 2 | 3 | 7 | 9 |
| n(Y)mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前 2 min 的平均速率 v(Z)=2.0×10-3 mol/(L•min) | |
| B. | 其他条件不变,降低温度,反应达到新平衡前 v(逆)>v(正) | |
| C. | 该温度下此反应的平衡常数 K=1.44 | |
| D. | 其他条件不变,再充入 0.2 mol Z,平衡时 X 的体积分数增大 |
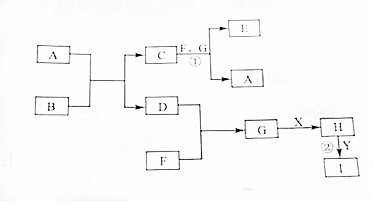 有关物质的转化关系如图所示(部分物质与条件已略去).其中A,D,F,G为常见的气体,D为单质,A,F,G为氧化物,G为棕红色;B为淡黄色固体.X是最常见的液体,Y是常见的金属单质,I溶液为蓝色,
有关物质的转化关系如图所示(部分物质与条件已略去).其中A,D,F,G为常见的气体,D为单质,A,F,G为氧化物,G为棕红色;B为淡黄色固体.X是最常见的液体,Y是常见的金属单质,I溶液为蓝色, .
.