题目内容
7.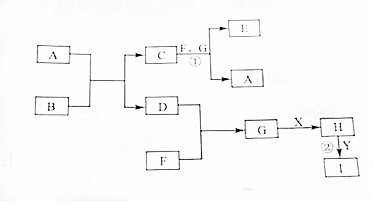 有关物质的转化关系如图所示(部分物质与条件已略去).其中A,D,F,G为常见的气体,D为单质,A,F,G为氧化物,G为棕红色;B为淡黄色固体.X是最常见的液体,Y是常见的金属单质,I溶液为蓝色,
有关物质的转化关系如图所示(部分物质与条件已略去).其中A,D,F,G为常见的气体,D为单质,A,F,G为氧化物,G为棕红色;B为淡黄色固体.X是最常见的液体,Y是常见的金属单质,I溶液为蓝色,请回答下列问题:
(1)B的化学式为Na2O2.
(2)A的电子式为
 .
.(3)写出反应①的化学方程式(C、F、G物质的量之比为1:1:1):Na2CO3+NO+NO2=2NaNO2+CO2.
(4)写出反应②的离子方程式(反应时H为稀溶液):3Cu+8H++2NO3-(稀)═3Cu2++2NO↑+4H2O.
分析 G为棕红色气体,应为NO2,B为淡黄色固体,为Na2O2,X是最常见的液体,为H2O,由转化关系可知A为CO2,则C为Na2CO3,D为O2,H为HNO3,Y是常见的金属单质,I溶液为蓝色,可知Y为Cu,I为Cu(NO3)2,F为NO,反应①生成W为NaNO2,以此解答该题.
解答 解:(1)由以上分析可知B为Na2O2,故答案为:Na2O2;
(2)A为CO2,电子式为 ,故答案为:
,故答案为: ;
;
(3)反应①C、F、G物质的量之比为1:1:1,生成W为NaNO2,方程式为Na2CO3+NO+NO2=2NaNO2+CO2,
故答案为:Na2CO3+NO+NO2=2NaNO2+CO2;
(4)铜和稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:3Cu+8H++2NO3-(稀)═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-(稀)═3Cu2++2NO↑+4H2O.
点评 本题考查无机物推断,为高频考点,侧重考查学生的分析能力以及元素化合物知识的综合理解和运用的考查,题目涉及Na、N、Cu元素单质化合物知识,G、B的性质是推断突破口,难度中等.

练习册系列答案
相关题目
18.下列有关物质的性质或用途的叙述中不正确的是( )
| A. | 碳酸氢钠可用于治疗胃酸过多 | |
| B. | 用氯化钡溶液可鉴别SO42-和CO32- | |
| C. | CO、NO、NO2都是大气污染物 | |
| D. | 常温下,可用铝制或铁制槽车运输浓硫酸 |
2. 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )
 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )| A. | 电池工作时,正极反应式为O2+2H2O+4e-═4OH | |
| B. | 电解时,电子流动路径是负极→外电路→阴极→溶液→阳极→正极 | |
| C. | 试管中NaOH溶液用来吸收电解时产生的Cl2 | |
| D. | 当电池中消耗2.24L(标准情况下)H2时,b极周围会产生0.021mol气体 |
12.常温下,关于pH相等的NaOH与NH3•H2O溶液,下列说法正确的是( )
| A. | c(NaOH)>c(NH3•H2O) | |
| B. | c(Na+)=c(NH4+) | |
| C. | 等体积的NaOH与NH3•H2O溶液分别与足量的Si完全反应,NH3•H2O产生的H2多 | |
| D. | 用相同浓度的盐酸溶液分别与等体积的NaOH与NH3•H2O溶液恰好反应完全,NaOH消耗的盐酸溶液体积多 |
19.从下列事实所得出的相应结论正确的是( )
| 实 验 事 实 | 结 论 | |
| ① | 在相同温度下,向1mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| ② | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| ③ | 在测定溶液中氯离子含量的时候,使用黄色的铬酸钾(K2CrO4)溶液充当指示剂 | 溶度积常数:铬酸银>氯化银 |
| ④ | 已知乙醇和乙酸都能与金属钠反应放出氢气 | 乙醇和乙酸都是电解质 |
| ⑤ | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| A. | ③④⑤ | B. | ②⑤ | C. | ①②③ | D. | 全部 |
17.化学是一门以实验为基础的学科.下列实验操作正确的是( )
| A. |  检查装置气密性 | B. |  量取 | ||
| C. |  稀释浓硫酸 | D. |  萃取时振荡混合液 |

