题目内容
14.室温下,有如下三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )| A. | 将pH=3 的①溶液与pH=11的②溶液等体积混合,溶液pH>7 | |
| B. | 若三种溶液浓度相同,将溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-) | |
| C. | 将①、②等浓度体积混合,混合液中c(CH3COO-)+c(CH3COOH)═c(Na+) | |
| D. | 若②、③的pH值相同,则两种溶液中水的电离程度相同 |
分析 A.醋酸是弱酸,部分电离,NaOH是强电解质完全电离,pH=3的醋酸浓度大于pH=11的NaOH,二者等体积混合,醋酸有剩余;
B.若三种溶液浓度相同,将溶液①、②等体积混合,二者恰好完全反应生成CH3COONa,但浓度是③的一半;
C.将溶液①、②等体积混合,二者恰好完全反应生成CH3COONa,溶液中存在物料守恒,根据物料守恒判断;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离.
解答 解:A.醋酸是弱酸,部分电离,NaOH是强电解质完全电离,pH=3的醋酸浓度大于pH=11的NaOH,二者等体积混合,醋酸有剩余,醋酸电离程度大于醋酸根离子水解程度,所以混合溶液的pH<7,故A错误;
B.若三种溶液浓度相同,将溶液①、②等体积混合,二者恰好完全反应生成CH3COONa,但浓度是③的一半,部分醋酸根离子水解且浓度越大醋酸根离子水解程度越小,所以混合液中c(CH3COO-)小于溶液③中的c(CH3COO-),故B错误;
C.将溶液①、②等体积混合,二者恰好完全反应生成CH3COONa,溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)═c(Na+),故C正确;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离,所以前者抑制水电离、后者促进水电离,故D错误;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,涉及盐类水解、弱电解质的电离等知识点,明确溶液中溶质及其性质是解本题关键,易错选项是B,注意二者混合后溶液体积增大,为易忽略点,题目难度不大.

练习册系列答案
相关题目
2.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )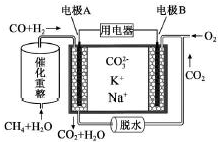

| A. | 正极产物为CO2 | |
| B. | 负极电极反应式为CO-2e-+CO32-═2CO2 | |
| C. | 电池工作时,CO32-向电极A移动 | |
| D. | 电池总反应式为CO+H2+O2═2CO2+H2O |
9.某同学测得物质的量浓度均为0.01mol/L CH3COOH和CH3COONa混合溶液呈酸性后,得出了关系式,你认为其中不正确的是( )
| A. | c(CH3COOH)<c(Na+) | B. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | ||
| C. | c(CH3COOH)+c(H+)═c(CH3COO-)+c(OH-) | D. | c(CH3COOH)+c(CH3COO-)═0.02 mol/L |
4.下列关于物质的量浓度的表述中正确的是( )
| A. | 0.3 mol/L Na2SO4溶液中含有Na+和SO42-总物质的量为0.9mol | |
| B. | 当1L水吸收22.4LNH3时所得氨水的浓度不是1 mol/L,只有当22.4L NH3溶于水制得1L氨水时,其浓度才是1 mol/L | |
| C. | 10℃时0.5 mol/L的稀盐酸100mL,蒸发掉5g水,冷却到10℃时,其体积小于100mL,它的物质的量浓度大于0.5 mol/L | |
| D. | 10℃时0.5 mol/L的KCl饱和溶液100mL,蒸发掉5g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.5 mol/L |
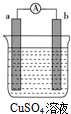 某原电池的装置如图所示,看到a极上有红色金属析出,回答下列问题:
某原电池的装置如图所示,看到a极上有红色金属析出,回答下列问题:
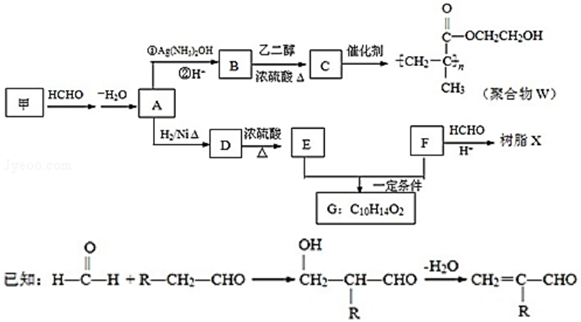
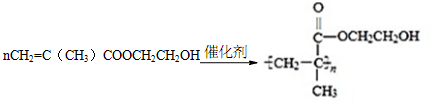 .
.
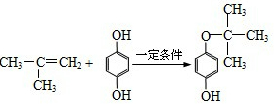 ,反应类型是加成反应.
,反应类型是加成反应.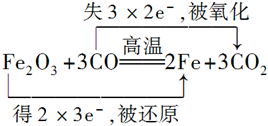 .
. .
. .
.