题目内容
16.在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4?2NO2△H>0,隔一段时间对该容器内的物质进行分析,得到如表数据:| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)计算在80℃时该反应的平衡常数K=1.8mol/L.
(3)40s时,NO2的浓度b=0.2mol/L,反应最迟到80s到达平衡状态
(4)反应进行至100s后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”“变深”或“不变”).
(5)要增大该反应的K值,可采取的措施有D(填序号).
A、增大N2O4的起始浓度B、向混合气体中通入NO2C、使用高效催化剂 D、升高温度.
分析 (1)0~40s内,N2O4减少0.40-0.20=0.20mol,结合v=$\frac{△c}{△t}$计算;
(2)由表格数据可知,80min达到平衡,则
N2O4?2NO2
开始 0.4 0
转化 0.3 0.6
平衡 0.1 0.6
结合平衡浓度计算K;
(3)40s时N2O4减少0.40-0.20=0.20mol,由反应可知生成NO2为0.2mol×2=0.4mol,结合c=$\frac{n}{V}$及平衡时物质的量不变分析;
(4)△H>0,100s后将反应混合物的温度降低,平衡逆向移动;
(5)K只与温度有关.
解答 解:(1)0~40s内,N2O4减少0.40-0.20=0.20mol,0~40s内用N2O4表示的平均反应速率为$\frac{\frac{0.2mol}{2L}}{40s}$=0.0025mol•L-1•s-1,故答案为:0.0025;
(2)由表格数据可知,80min达到平衡,则
N2O4?2NO2
开始 0.4 0
转化 0.3 0.6
平衡 0.1 0.6
平衡浓度分别为0.05mol/L、0.3mol/L,则K=$\frac{0.{3}^{2}}{0.05}$=1.8 mol/L,
故答案为:1.8 mol/L;
(3)40s时N2O4减少0.40-0.20=0.20mol,由反应可知生成NO2为0.2mol×2=0.4mol,浓度为$\frac{0.4mol}{2L}$=0.2 mol/L,由表格数据可知80 s时达到平衡状态,
故答案为:0.2;80;
(4)△H>0,100s后将反应混合物的温度降低,平衡逆向移动,混合气体的颜色变浅,故答案为:变浅;
(5)K只与温度有关,该反应为吸热反应,升高温度,K增大,只有D符合,故答案为:D.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、速率及K的计算、平衡移动为解答的关键,侧重分析与计算能力的考查,注意表格数据的应用,题目难度不大.

| A. | HCl和Na2CO3 | B. | 稀H2SO4和NaHCO3 | C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
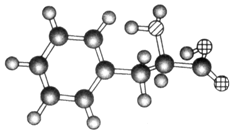
| A. | 该物质的结构简式为 | |
| B. | 该物质可以发生加成反应 | |
| C. | 该物质既可以与强酸反应也可以与强碱反应 | |
| D. | 该物质可以聚合成高分子物质 |
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 2.00 | 0.00 |
| 1 | 0.90 | 1.80 | 0.20 |
| 3 | 0.75 | 1.50 | 0.50 |
| 5 | 0.65 | 1.30 | 0.70 |
| 9 | 0.55 | 1.10 | 0.90 |
| 10 | 0.55 | 1.10 | 0.90 |
| 14 | 0.55 | 1.10 | 0.90 |
 2Z
2Z②该反应在0~5min时间内产物Z的平均反应速率:0.014mol/(L•min)
③该反应达到平衡时反应物X的转化率α等于45%.
| A. | 常温常压下,22.4LCO2含有的分子数为1NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA | |
| C. | 通常状况下,NA个CO2分子占有的体积约为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
| A. | 在任何条件下,纯水的pH=7 | |
| B. | 盐类对水的电离都有促进作用 | |
| C. | 在95℃时,纯水的pH>7 | |
| D. | 在95℃时,纯水中H+的物质的量浓度c(H+)>10-7mol/L |
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 | |
| C. | 将0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 | |
| D. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) |