题目内容
4.某物质的球棍模型如图所示,关于该物质的说法不正确的是( )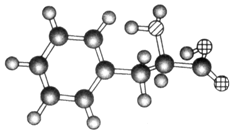
| A. | 该物质的结构简式为 | |
| B. | 该物质可以发生加成反应 | |
| C. | 该物质既可以与强酸反应也可以与强碱反应 | |
| D. | 该物质可以聚合成高分子物质 |
分析 由结构简式可知,该物质为C6H5CH2CH(NH2)COOH,结合苯、氨基、羧基的性质来解答.
解答 解:A.由结构简式可知,该物质为C6H5CH2CH(NH2)COOH,故A错误;
B.含苯环,则该物质能发生发生加成反应,故B正确;
C.含有氨基和羧基,则既可以与强酸反应也可以与强碱反应,故C正确;
D.含有氨基、羧基,可发生缩聚反应生成高分子化合物,故D正确.
故选A.
点评 本题考查有机物的结构与性质,为高考常见题型,把握有机物的官能团、性质的关系为解答的关键,熟悉氨基酸的性质即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.实验室中需要配制2mol/L的NaCl溶液920mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
| A. | 920 mL,107.64 g | B. | 500 mL,117 g | ||
| C. | 1000 mL,117.0g | D. | 任意规格,107.64 g |
16.在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4?2NO2△H>0,隔一段时间对该容器内的物质进行分析,得到如表数据:
(1)计算0~40s内用N2O4表示的平均反应速率为0.0025mol•L-1•s-1.
(2)计算在80℃时该反应的平衡常数K=1.8mol/L.
(3)40s时,NO2的浓度b=0.2mol/L,反应最迟到80s到达平衡状态
(4)反应进行至100s后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”“变深”或“不变”).
(5)要增大该反应的K值,可采取的措施有D(填序号).
A、增大N2O4的起始浓度B、向混合气体中通入NO2C、使用高效催化剂 D、升高温度.
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)计算在80℃时该反应的平衡常数K=1.8mol/L.
(3)40s时,NO2的浓度b=0.2mol/L,反应最迟到80s到达平衡状态
(4)反应进行至100s后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”“变深”或“不变”).
(5)要增大该反应的K值,可采取的措施有D(填序号).
A、增大N2O4的起始浓度B、向混合气体中通入NO2C、使用高效催化剂 D、升高温度.