题目内容
15. 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.(1)起始时X的浓度是0.5mol/l;
(2)由图中所给数据进行分析,该反应的化学方程式为3X+Y?2Z;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=_0.1mol/(L•min);
(4)当反应进行到1min时v(正)>v(逆) (填“>”、“<”或“=”),当反应进行到第2min,该反应达到平衡.3min时反应是进行(填”进行“或”“停止”)
分析 (1)根据c=$\frac{n}{V}$计算;
(2)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(3)分析图象Z的消耗物质的量为0.2mol,结合反应速率v=$\frac{△c}{△t}$计算;
(4)分析图象,1min时反应物正在减少,生成物在增加,正在向正方向进行;各物质的量不再改变即到达平衡;根据可逆反应的特征,动态平衡,并未静止.
解答 解:(1)根据图象X的起始物质的量为1.0mol,则起始时X的浓度为:$\frac{1.0mol}{2L}$=0.5mol/l;
故答案为:0.5mol/l;
(2)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y?2Z;
故答案为:3X+Y?2Z
(3)分析图象Z的消耗物质的量为0.2mol,则v(Z)=$\frac{△c}{△t}$=$\frac{0.2mol÷2L}{2min}$=0.1mol/(L•min);
故答案为:0.1mol/(L•min);
(4)当反应进行到1min时,反应物在减少,生成物在增多,说明此时正在向正反应方向进行,则v(正)>v(逆);反应进行到2min时,各物质的量不再改变,说明达到平衡状态;可逆反应的平衡状态是一个动态平衡,反应在进行并未停止;
故答案为:>;2;进行.
点评 本题考查了化学反应速率的计算应用、可逆反应平衡状态的特征等,图象分析和反应进行方向的判断方法是解题关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.关于下列各装置图的叙述中,正确的是( )
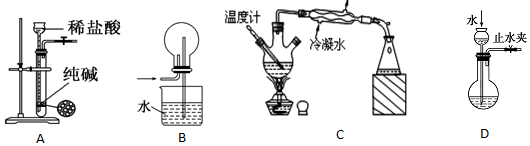

| A. | 用图A装置制取少量CO2气体 | |
| B. | 多余的NH3可用图B装置吸收 | |
| C. | 装置C可分离沸点不同且互溶的液体混合物 | |
| D. | 图D可检查装置的气密性 |
6.在一定温度下,硫酸铜晶体的培养皿中存在下列平衡:Cu2+(aq)+SO42-(aq)+xH2O(l)?CuSO4•xH2O(s),当向溶液中加少量无水硫酸铜粉末后,下列说法中正确的是( )
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目减少 | ||
| C. | 该溶液的pH减小 | D. | 溶液的蓝色变浅 |
3.氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间隙法”制取,反应原理、实验装置图(加热装置都已略去)如下:
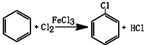
已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压,冷凝管中冷水应从a(填“a”或“b”) 处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气;
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;HCl+NaOH=NaCl+H2O;(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙;
(5)工业生产中苯的流失情况如下:
则lt苯可制得成品为$\frac{(1-0.0892)×112.5}{78}$t(只要求列式).

已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压,冷凝管中冷水应从a(填“a”或“b”) 处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气;
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;HCl+NaOH=NaCl+H2O;(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙;
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
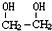 )是一种重要的化工原料,
)是一种重要的化工原料, (g)△H=a kJ/mol
(g)△H=a kJ/mol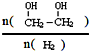 增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来(写两条)
增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来(写两条)