题目内容
下列说法中正确的是( )
| A、分子中键能越大,键长越长,则分子越稳定 |
| B、sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道 |
| C、PCl5分子中P原子和Cl原子最外层都满足8电子结构 |
| D、用价层电子互斥理论预测H2S和BF3的立体结构,分别为V形和平面正三角形 |
考点:键能、键长、键角及其应用,判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:A、根据键能、键长与分子稳定性的关系分析;
B、能量不同的轨道杂化后变成能量相同的轨道;
C、PCl5中P元素化合价为+5价,P原子最外层电子数是5,5+5=10,则P原子不满足8电子结构;
D、价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果.
B、能量不同的轨道杂化后变成能量相同的轨道;
C、PCl5中P元素化合价为+5价,P原子最外层电子数是5,5+5=10,则P原子不满足8电子结构;
D、价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果.
解答:
解:A、分子中键能越大,键越短,则分子越稳定,故A错误;
B、同一个原子中能量相近的s轨道和p轨道通过杂化可形成混合起来形成的一组能量相同的新轨道,杂化轨道数=孤电子对数+与之相连的原子数,故B正确;
C、PCl5中P元素化合价为+5价,P原子最外层电子数是5,5+5=10,则P原子不满足8电子结构,故C错误;
D、H2S分子的中心原子S原子上含有2个σ 键,中心原子上的孤电子对数=
(a-xb)=
(6-2×1)=2,所以硫化氢分子的VSEPR模型是四面体型,略去孤电子对后,实际上其空间构型是V型;
BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=
(a-xb)=
(0-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,故D正确.
故选:BD.
B、同一个原子中能量相近的s轨道和p轨道通过杂化可形成混合起来形成的一组能量相同的新轨道,杂化轨道数=孤电子对数+与之相连的原子数,故B正确;
C、PCl5中P元素化合价为+5价,P原子最外层电子数是5,5+5=10,则P原子不满足8电子结构,故C错误;
D、H2S分子的中心原子S原子上含有2个σ 键,中心原子上的孤电子对数=
| 1 |
| 2 |
| 1 |
| 2 |
BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=
| 1 |
| 2 |
| 1 |
| 2 |
故选:BD.
点评:本题考查了键参数、分子构型、原子轨道及其杂化的判断,根据价层电子对互斥理论确定其杂化方式即可,难度较大.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
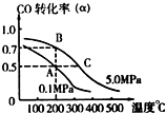 密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)=CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示.下列说法正确的是( )
密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)=CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示.下列说法正确的是( )| A、在 A、B两点对应的容器中,n(A)总:n(B)总=4:5 |
| B、在 A、C两点对应的容器中自反应开始到平衡状态所需的时间tA,<tC |
| C、设B、C两点的平衡常数分别为KB、KC,则KB<KC |
| D、在不改变反应物用量的情况下,降温、加压、将甲醇从混合体系中分离出来均可提高CO的转化率 |
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A、一定条件下,1.5 mol H2和0.5 mol N2充分反应后可得到NH3分子数为NA |
| B、足量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.3NA |
| C、常温常压下,18g H2O含有的电子总数为8NA |
| D、标准状况下,22.4L的己烯中含有的分子数为NA |
设NA表示阿伏加德罗常数的值.下列叙述不正确的是( )
| A、1molNa2O和Na2O2的混合物中含有的阴、阳离子总数是3NA |
| B、常温下,1L0.1 mol?L-1的NH4NO3溶液中含有的氮原子数为0.2NA |
| C、46g有机物C2H6O中含有的H-O键的数目为NA |
| D、标准状况下,将0.1molCl2通入足量NaOH溶液中,反应转移的电子数为0.1NA |
下列离子方程式或化学方程式与所述事实相符且正确的是( )
| A、将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则2SO3(g)?2SO2(g)+O2(g)△H=+Q KJ/mol |
| B、向含有0.4molFeBr2的溶液中通入0.2molCl2充分反应:2Fe2++Cl2=2Fe3++2Cl- |
| C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D、将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
核电荷数为1~18的元素中,下列说法不正确的是( )
| A、最外层只有1个电子的元素不一定是金属元素 |
| B、最外层有2个电子的元素不一定是金属元素 |
| C、原子核外各层电子数相等的元素一定是金属元素 |
| D、最外层电子数为7的原子,最高正价为+7 |
下列有关有机化合物的叙述中正确的是( )
| A、汽油是纯净物,乙醇汽油是混合物 |
| B、煤干馏可以得到甲烷、苯和氨等重要化工原料 |
| C、乙烯、乙醇、和乙酸均能发生加成反应 |
| D、变质的油脂有难闻的特殊气味,是因为油脂发生了加成反应 |
以下基态原子的电子排布式不符合构造原理的是( )
| A、1s22s22p63s23p63d74s2 |
| B、1s22s22p63s23p63d54s1 |
| C、1s22s22p63s23p63d104s24p1 |
| D、1s22s22p63s23p64s2 |