题目内容
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A、一定条件下,1.5 mol H2和0.5 mol N2充分反应后可得到NH3分子数为NA |
| B、足量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.3NA |
| C、常温常压下,18g H2O含有的电子总数为8NA |
| D、标准状况下,22.4L的己烯中含有的分子数为NA |
考点:阿伏加德罗常数
专题:
分析:A.合成氨的反应为可逆反应,反应物不可能完全转化成生成物;
B.铁与氯气反应生成氯化铁,生成0.1mol氯化铁转移了0.3mol电子;
C.水分子中含有10个电子,18g水的物质的量为1mol,含有10mol电子;
D.标况下己烷的状态不是气体,不能使用标况下的气体摩尔体积计算己烷的物质的量.
B.铁与氯气反应生成氯化铁,生成0.1mol氯化铁转移了0.3mol电子;
C.水分子中含有10个电子,18g水的物质的量为1mol,含有10mol电子;
D.标况下己烷的状态不是气体,不能使用标况下的气体摩尔体积计算己烷的物质的量.
解答:
解:A.1.5 mol H2和0.5 mol N2充分反应后,由于该反应为可逆反应,则反应生成的氨气小于1mol,反应后得到的NH3分子数小于NA,故A错误;
B.铁与氯气反应生成氯化铁,则足量的Fe与Cl2反应生成0.1mol产物时失去0.3mol电子,失去的电子数为0.3NA,故B正确;
C.18g水的物质的量为1mol,1mol水分子中含有10mol电子,含有的电子总数为10NA,故C错误;
D.标况下己烷不是气体,不能使用气体摩尔体积计算己烷的物质的量,故D错误;
故选B.
B.铁与氯气反应生成氯化铁,则足量的Fe与Cl2反应生成0.1mol产物时失去0.3mol电子,失去的电子数为0.3NA,故B正确;
C.18g水的物质的量为1mol,1mol水分子中含有10mol电子,含有的电子总数为10NA,故C错误;
D.标况下己烷不是气体,不能使用气体摩尔体积计算己烷的物质的量,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以分子、原子、原子核内质子中子及核外电子的构成关系,选项A为易错点,注意合成氨的反应为可逆反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
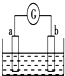 如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )| A、a为负极,是铁片,烧杯中的溶液为稀硫酸 |
| B、b为负极,是铁片,烧杯中的溶液为硫酸铜溶液 |
| C、a为正极,是碳棒,烧杯中的溶液为稀硫酸 |
| D、b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液 |
某课外兴趣小组通过实验发现钾和钠的化学性质相似,下列说法中能最恰当地解释这个事实的是( )
| A、都是金属元素 |
| B、原子半径相差不大 |
| C、原子结构相似,最外层电子数相同 |
| D、最高化合价相同 |
NA代表阿伏加德罗常数,下列说法不正确的是( )
| A、标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA |
| B、常温常压下,15g甲基(-CH3)所含的电子数为9NA |
| C、同温同压下,1LNO和1LO2充分混合体积小于1.5L |
| D、pH=l的醋酸溶液100mL中氢离子数为0.01 NA |
在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况,下列反应中属于这种情况的是( )
①过量的锌与浓硫酸反应;
②过量的氢气与少量的N2在工业生产条件下反应;
③过量的浓盐酸与碳酸钙反应;
④过量的乙酸和少量乙醇在浓硫酸、加热条件下反应;
⑤过量二氧化锰与浓盐酸在加热条件下反应;
⑥过量的铜与浓硫酸在加热条件下反应.
①过量的锌与浓硫酸反应;
②过量的氢气与少量的N2在工业生产条件下反应;
③过量的浓盐酸与碳酸钙反应;
④过量的乙酸和少量乙醇在浓硫酸、加热条件下反应;
⑤过量二氧化锰与浓盐酸在加热条件下反应;
⑥过量的铜与浓硫酸在加热条件下反应.
| A、②③④⑥ | B、①②④⑤ |
| C、②④⑤⑥ | D、③④⑤⑥ |
下列说法中正确的是( )
| A、分子中键能越大,键长越长,则分子越稳定 |
| B、sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道 |
| C、PCl5分子中P原子和Cl原子最外层都满足8电子结构 |
| D、用价层电子互斥理论预测H2S和BF3的立体结构,分别为V形和平面正三角形 |
 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.