题目内容
以下基态原子的电子排布式不符合构造原理的是( )
| A、1s22s22p63s23p63d74s2 |
| B、1s22s22p63s23p63d54s1 |
| C、1s22s22p63s23p63d104s24p1 |
| D、1s22s22p63s23p64s2 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:根据原子的构造原理可知,大多数电子按轨道能量顺序1s2s2p3s3p4s3d4p5s4d5p6s…由里向外排布,但当轨道上电子数呈半满时,能量更低,原子更稳定,会出现反常情况,据此答题.
解答:
解:A、1s22s22p63s23p63d74s2是Co原子的电子排布式,符合构造原理,故A错误;
B、1s22s22p63s23p63d54s1是Cr的电子排布式,根据能量最低原理,在4d和5s轨道上,电子数处于半满状态,这样更稳定,但不符合构造原理,是核外电子排布的特殊情况,故B正确;
C、1s22s22p63s23p63d104s24p1是Ga原子的电子排布式,符合构造原理,故C错误;
D、1s22s22p63s23p63d104s2是Zn原子的电子排布式,符合构造原理,故D错误;
故选B.
B、1s22s22p63s23p63d54s1是Cr的电子排布式,根据能量最低原理,在4d和5s轨道上,电子数处于半满状态,这样更稳定,但不符合构造原理,是核外电子排布的特殊情况,故B正确;
C、1s22s22p63s23p63d104s24p1是Ga原子的电子排布式,符合构造原理,故C错误;
D、1s22s22p63s23p63d104s2是Zn原子的电子排布式,符合构造原理,故D错误;
故选B.
点评:本题主要考查构造原理,难度不大,解题时要注意构造原理和能量最低原理相结合分析问题.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、分子中键能越大,键长越长,则分子越稳定 |
| B、sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道 |
| C、PCl5分子中P原子和Cl原子最外层都满足8电子结构 |
| D、用价层电子互斥理论预测H2S和BF3的立体结构,分别为V形和平面正三角形 |
将铜粉放入稀硫酸中,加热无明显现象发生.但加入某盐后,发现铜粉质量逐渐减少,则该盐可能是( )
| A、Fe2(SO4)3 |
| B、ZnSO4 |
| C、KNO3 |
| D、NaCl |
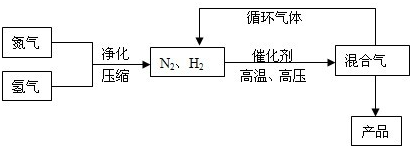
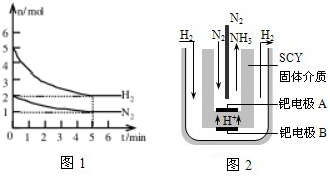
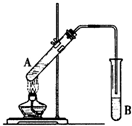 在试管A中加入3mL乙醇,然后边振荡管边慢慢加入2mL浓硫酸和2mL乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入3mL乙醇,然后边振荡管边慢慢加入2mL浓硫酸和2mL乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.
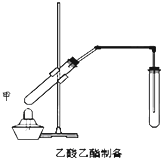 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答: