题目内容
17.下列反应中,△S<0的是( )| A. | H2(g)+Br2(g)?2HBr(g) | B. | 2N2O5(g)=4NO2(g)+O2(g) | ||
| C. | 2SO2(g)+O2?2SO3(g) | D. | CaCO3(s)=CaO(s)+CO2(g) |
分析 熵变是反应体系的混乱度,是体系混乱度(或无序度)的量度,同一物质,气态熵大于液态熵,液态熵大于固态熵;不同物质生成的气体体积越大,熵值增加,熵变为正值.气体体积减少,熵值减小,熵变为负值.
解答 A、反应前后气体物质的量不变,△S=0,故A错误;
B、反应物有2mol气体生成物为5mol气体,△S>0,故B错误;
C、反应物气体物质的量大于生成物,△S<0,故C正确;
D、生成物气体物质的量大于反应物,△S>0,故D错误;
故选C.
点评 本题考查了反应熵变的概念和理解,结合反应及变化的特征分析判断熵值的变化是解题关键,题目难度不大.

练习册系列答案
相关题目
8.下列关于钢管腐蚀与电化防护的说法正确的是( )
| A. | 钢管与电源正极连接,钢管不易被腐蚀 | |
| B. | 通常情况下,钢管的电化腐蚀主要是吸氧腐蚀 | |
| C. | 钢管与铜管露天堆放在一起,钢管不易被腐蚀 | |
| D. | 钢管发生析氢腐蚀时,负极反应是Fe-3e→Fe3+ |
8.设NA为阿伏加德罗常败的数值,下列说法错误的是( )
| A. | 0.1 mol羟基 ( 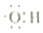 ) 中含有的电子数为0.7NA ) 中含有的电子数为0.7NA | |
| B. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA | |
| C. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COC-数目为NA | |
| D. | 14g乙烯与丙烯混合气体中的氢原子数为2NA |
5.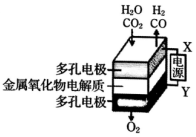 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | 阴极的反应式是:H2O+2e-=H2+O2-、CO2+2e-=CO+O2- | |
| B. | X是电源的负极 | |
| C. | 总反应可表示为:H2O+CO2=H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
12.反应C(s)+H2O?CO(g)+H2(g)△H>0,达到平衡时,下列说法正确的是( )
| A. | 加入催化剂,平衡常数不变 | |
| B. | 减小容器体积,正、逆反应速率均减小 | |
| C. | 增大C的量,H2O的转化率增大 | |
| D. | 升高温度,平衡向逆反应方向移动 |
2.饱和氯水长期放置后,下列微粒在溶液中不减少的是( )
| A. | HClO | B. | Cl- | C. | Cl2 | D. | ClO- |
9.已知单质碘受热易升华.从海带中提取碘的实验过程中涉及下列操作正确的是( )
| A. |  灼烧海带 | B. |  过滤得含I-的溶液 | ||
| C. | 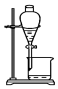 放出碘的苯溶液 | D. | 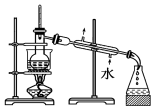 分离碘并回收苯 |
6.下列有关 Na2CO3 和 NaHCO3 的说法错误的是( )
| A. | 等质量 Na2CO3 和 NaHCO3 分别和足量盐酸反应,相同条件下前者生成 CO2 少 | |
| B. | 将石灰水分别加入 NaHCO3 和 Na2CO3 中,前者不生成沉淀 | |
| C. | 相同条件下 Na2CO3 比 NaHCO3 更易溶于水 | |
| D. | Na2CO3 固体中含少量 NaHCO3,可用加热法除去 |
7.下列有关概念和原理的说法正确的是( )
| A. | 酸和碱反应只能生成盐和水 | |
| B. | ${\;}_{7}^{14}$N+${\;}_{0}^{1}$n→${\;}_{6}^{12}$C+${\;}_{1}^{3}$H,此过程为化学变化 | |
| C. | 金属主要发生吸氧腐蚀,其本质是被氧化 | |
| D. | Na2O2的水溶液能导电,所以Na2O2是电解质 |