题目内容
9.已知单质碘受热易升华.从海带中提取碘的实验过程中涉及下列操作正确的是( )| A. | 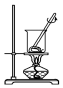 灼烧海带 | B. | 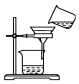 过滤得含I-的溶液 | ||
| C. | 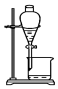 放出碘的苯溶液 | D. | 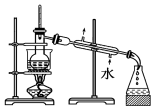 分离碘并回收苯 |
分析 A.灼烧在坩埚后者进行;
B.过滤需要玻璃棒引流;
C.碘的苯溶液在上层;
D.蒸馏时测定馏分的温度,冷水下进上出.
解答 解:A.灼烧在坩埚后者进行,不能选烧杯,故A错误;
B.过滤需要玻璃棒引流,图中缺少玻璃棒,故B错误;
C.碘的苯溶液在上层,应从上口倒出,故C错误;
D.蒸馏时测定馏分的温度,冷水下进上出,图中蒸馏装置合理,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
20.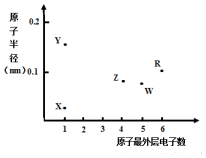 X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法错误的是( )
X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法错误的是( )
 X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法错误的是( )
X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法错误的是( )| A. | 简单离子半径:Y<W | |
| B. | 最高价氧化物对应水化物的酸性:Z<W | |
| C. | R为氧元素 | |
| D. | X与Z可以形成正四面体结构的分子 |
20.下列溶液中,与100ml 0.5mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
| A. | 100 ml 0.5 mol/L MgCl2 溶液 | B. | 200 ml 0.25 mol/L HCl溶液 | ||
| C. | 50 ml 1 mol/L NaCl溶液 | D. | 200 ml 0.25 mol/L CaCl2溶液 |
17.下列反应中,△S<0的是( )
| A. | H2(g)+Br2(g)?2HBr(g) | B. | 2N2O5(g)=4NO2(g)+O2(g) | ||
| C. | 2SO2(g)+O2?2SO3(g) | D. | CaCO3(s)=CaO(s)+CO2(g) |
4.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比是( )
| A. | 1:1 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
14.用O2将HCl转化为Cl2,反应方程式为:4HCl(g)+O2(g)?2H2O(g)+2Cl2(g)△H>0 一定条件下在1L密闭容器中测得反应过程中n(Cl2)的实验数据如表.下列说法正确的是( )
| t/min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A. | 0~2 min的反应速率小于4~6 min的反应速率 | |
| B. | 2~6 min用Cl2表示的反应速率为0.9 mol/(L•min) | |
| C. | 降低温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 平衡常数:K(200℃)<K(400℃) |
1.下列各物质中,所含分子数相同的是( )
| A. | 10gCH4和 10gO2 | B. | 11.2LN2(标准状况)和 11g CO2 | ||
| C. | 9 g H2O 和 0.5mol Cl2 | D. | 224mL H2(标准状况)和 0.1mol N2 |
19.向CuSO4溶液中逐滴加入KI溶液至过量,观察到有沉淀(CuI)生成,且溶液变为棕色,再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色.下列有关分析中正确的是( )
| A. | 上述实验条件下,物质的氧化性:Cu>SO2>I2 | |
| B. | 在SO2与I2反应中得到的还原产物为H2SO4 | |
| C. | 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 | |
| D. | 滴加KI溶液时.每转移2mole-会生成2molCuI沉淀 |