题目内容
2.不符合“绿色城运会”主题的是( )| A. | 推广使用燃煤脱硫技术,防治SO2污染 | |
| B. | 使用天然气热水器取代电热水器 | |
| C. | 推荐使用手帕,尽量减少使用面纸 | |
| D. | 在建筑、布展、运营过程中应用大规模的太阳能光伏发电系统 |
分析 A.燃煤脱硫技术可以减少二氧化硫的生成;
B.天然气燃烧会产生大气污染物;
C.使用面纸会消耗大量的木材;
D.太阳能属于无污染的可再生能源.
解答 解:A.煤炭中的硫在燃烧时会生成二氧化硫,燃煤脱硫技术可以减少二氧化硫的生成,能防治SO2污染,故A不选;
B.天然气燃烧会产生大气污染物,所以使用天然气热水器取代电热水器会加重空气污染,不符合“绿色城运会”主题,故B选;
C.使用面纸会消耗大量的木材,会使森林减少,使用手帕,尽量减少使用面纸可以保护森林,有利于环境,故C不选;
D.太阳能属于无污染的可再生能源,对环境无害,在建筑、布展、运营过程中应用大规模的太阳能光伏发电系统,可以减少环境污染,故D不选.
故选B.
点评 本题考查了环境保护,题目难度不大,环境污染已影响到人类的生产、生活、身体健康以及人类社会发展,学习时要注意污染的来源、危害、防治措施、变害为利的新工艺.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
10.有关合成氨工业的说法中,正确的是( )
| A. | 从合成塔出来的混合气体,其中NH3只占15%,所以合成氨工厂的效率都很低 | |
| B. | 由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高 | |
| C. | 合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动 | |
| D. | 合成氨工厂采用的压强是2×107~5×107Pa,因为在该压强下铁触媒的活性最大 |
17.天然气与二氧化碳在一定条件下反应制备合成气(CO+H2)的原理是CH4(g)+CO2(g)?2CO(g)+2H2(g)△H>0.该反应达到平衡之后,为了提高CH4的转化率,下列措施正确的是( )
| A. | 增大压强 | B. | 升高温度 | C. | 增大CH4浓度 | D. | 更换高效催化剂 |
7.下列说法正确的是( )
| A. | 在所有元素中,氟的第一电离能最大 | |
| B. | 氨气的水溶性大于甲烷的水溶性,原因是氨气分子之间能形成氢键 | |
| C. | 元素的金属性越强,其电负性一定越小 | |
| D. | 根据金属元素的逐级电离能数据可大致推断出此元素的最高化合价 |
14.若初始时在恒容密闭容器中加入N2O5,表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
①写出该反应的平衡常数表达式:K=$\frac{{c}^{4}(N{O}_{2})•c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$.
②1000s内N2O5的分解速率为:0.00252mol/(L•s).
③若每有1mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式2N2O5(g)=4NO2(g)+O2(g)△H=+2QkJ/mol.
| t/s | 0 | 500 | 1000 |
| c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
②1000s内N2O5的分解速率为:0.00252mol/(L•s).
③若每有1mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式2N2O5(g)=4NO2(g)+O2(g)△H=+2QkJ/mol.
11.无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为2Al2O3(s)+6Cl2(g)$\frac{\underline{\;高温\;}}{\;}$4AlCl3(g)+3O2(g)△H>0.下列分析错误的是( )
| A. | 增大反应体系的压强,反应速率增大 | |
| B. | 加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量 | |
| C. | 电解熔融的Al2O3和AlCl3均能得到单质铝 | |
| D. | 升高温度,反应的平衡常数将增大 |
12. 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
请回答下列问题:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2 (用K1、K2表示),
△H3═△H1+△H2 (用△H1、△H2表示);根据反应③判断△S<0(填“>”、“=”或“<”),在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有ADF(填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.降低温度 E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol•L-1、0.3mol•L-1、0.3mol•L-1、0.15mol•L-1,则此时v正<v逆(填“>”、“=”或“<”).
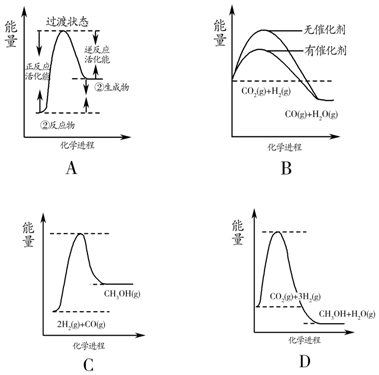
(5)根据表格测得焓变,下列能量关系图合理的是AD.
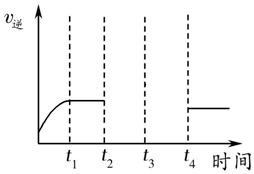
(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.
 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H3 | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2 (用K1、K2表示),
△H3═△H1+△H2 (用△H1、△H2表示);根据反应③判断△S<0(填“>”、“=”或“<”),在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有ADF(填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.降低温度 E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol•L-1、0.3mol•L-1、0.3mol•L-1、0.15mol•L-1,则此时v正<v逆(填“>”、“=”或“<”).
(5)根据表格测得焓变,下列能量关系图合理的是AD.

(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.
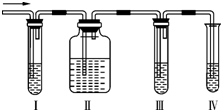 化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图所示的实验装置以确认上述混合气体中有C2H4和SO2.回答下列问题:
化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图所示的实验装置以确认上述混合气体中有C2H4和SO2.回答下列问题: