题目内容
13.反应N2+3H2?2NH3在固定容积的密闭容器中进行并达到平衡状态,此时,c(N2)=3.5mol/L,c(H2)=11mol/L,c(NH3)=5mol/L.求:(1)该温度下,反应的平衡常数是多少?
(2)N2和H2的起始浓度是多少?
(3)N2的转化率是多少?
(4)平衡时的压强与开始时的压强比是多少?
分析 设开始时N2和H2的起始浓度分别为x、y,则
N2+3H2?2NH3
开始 x y 0
转化 2.5 7.5 5
平衡 3.5 11 5
结合K为生成物浓度幂之积与反应物浓度幂之积的比、转化率=$\frac{转化的量}{开始的量}$×100%、物质的量比等于压强比计算.
解答 解:设开始时N2和H2的起始浓度分别为x、y,则
N2+3H2?2NH3
开始 x y 0
转化 2.5 7.5 5
平衡 3.5 11 5
(1)该温度下,反应的平衡常数K=$\frac{{5}^{2}}{3.5×1{1}^{3}}$=5.37×10-3(mol/L)-2,
答:该温度下,反应的平衡常数是5.37×10-3(mol/L)-2;
(2)N2的起始浓度为2.5+3.5=6mol/L,H2的起始浓度是11+7.5=18.5mol/L,
答:N2和H2的起始浓度分别是6mol/L、18.5mol/L;
(3)N2的转化率是$\frac{2.5mol/L}{6mol/L}$=41.7%,
答:N2的转化率是41.7%;
(4)平衡时的压强与开始时的压强比是$\frac{3.5+11+5}{6+18.5}$=39:49,
答:平衡时的压强与开始时的压强比是39:49.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K及转化率的计算为解答的关键,侧重分析与计算能力的考查,注意物质的量比等于压强比,题目难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
3.用”>”、”<”填写下表
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| O<N | Cl<F | NaCl<CaO | HF>HCl |
4.测定胆矾晶体(CuSO4•nH2O)里结晶水的n值时,出现下列三种情况:
①晶体中含有受热不分解的杂质;
②晶体尚带蓝色,即停止加热;
③加热过程中,晶体有部分爆溅飞出坩埚.
其中能使实验结果n值偏低的是( )
①晶体中含有受热不分解的杂质;
②晶体尚带蓝色,即停止加热;
③加热过程中,晶体有部分爆溅飞出坩埚.
其中能使实验结果n值偏低的是( )
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
8.实验室制备下列气体时,所用方法正确的是( )
| A. | 制乙烯时,用排水法或向上排空气法收集气体 | |
| B. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| C. | 制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| D. | 制二氧化氮时,用水或NaOH溶液吸收尾气 |
5.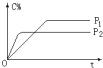 可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )
可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )
 可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )
可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )| A. | P1>P2,n>3 | B. | P1>P2,n<3 | C. | P1<P2,n<3 | D. | P1<P2,n>3 |
2.不符合“绿色城运会”主题的是( )
| A. | 推广使用燃煤脱硫技术,防治SO2污染 | |
| B. | 使用天然气热水器取代电热水器 | |
| C. | 推荐使用手帕,尽量减少使用面纸 | |
| D. | 在建筑、布展、运营过程中应用大规模的太阳能光伏发电系统 |