题目内容
11.无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为2Al2O3(s)+6Cl2(g)$\frac{\underline{\;高温\;}}{\;}$4AlCl3(g)+3O2(g)△H>0.下列分析错误的是( )| A. | 增大反应体系的压强,反应速率增大 | |
| B. | 加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量 | |
| C. | 电解熔融的Al2O3和AlCl3均能得到单质铝 | |
| D. | 升高温度,反应的平衡常数将增大 |
分析 A.增大压强对有气体参加的反应会增大反应速率;
B.碳消耗了生成物氧气,且放出热量,结合浓度、温度对该反应的影响分析;
C.氯化铝是共价化合物不能熔融电解生成铝;
D.该反应为吸热反应,升温后平衡向着正向移动,平衡常数增大.
解答 解:A.反应前后都有气体参加,增大反应体系的压强,反应速率会加快,故A正确;
B.加入碳粉,碳与O2反应降低了生成物的浓度,且放出热量,导致温度升高,使平衡向着正向移动,故B正确;
C.氯化铝是共价化合物,熔融状态下不导电,无法通过电解氯化铝获得金属铝,通常采用电解熔融氧化铝制备金属铝,故C错误;
D.该反应为吸热反应,升高温度,平衡向着正向移动,则反应的平衡常数将增大,故D正确;
故选C.
点评 本题考查了化学平衡的影响因素,题目难度中等,涉及化学平衡、化学反应速率的影响、反应热量变化、电解原理等知识,明确影响化学平衡、化学反应速率的因素为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
2.不符合“绿色城运会”主题的是( )
| A. | 推广使用燃煤脱硫技术,防治SO2污染 | |
| B. | 使用天然气热水器取代电热水器 | |
| C. | 推荐使用手帕,尽量减少使用面纸 | |
| D. | 在建筑、布展、运营过程中应用大规模的太阳能光伏发电系统 |
19.以下胆矾结晶水含量的测定操作中,正确的是( )
| A. | 恒重操作是指加热、冷却、称量这一过程重复两次 | |
| B. | 加热时不断用玻璃棒搅拌 | |
| C. | 加热时晶体不小心溅出坩埚,再加一些胆矾 | |
| D. | 为了节约时间,加热时直接用大火加热直至最后 |
6. Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于表:
回答下列问题:
(1)Mn元素价电子层的电子排布式为3d54s2,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是具有孤对电子;
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是sp,写出一种与CN-互为等电子体的单质分子的路易斯结构式:N≡N:;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮
等有机溶剂.据此判断三氯化铁晶体为分子晶体;
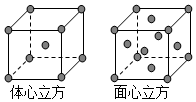
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际
含有的Fe原子个数之比为2:1.
 Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于表:| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(1)Mn元素价电子层的电子排布式为3d54s2,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是具有孤对电子;
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是sp,写出一种与CN-互为等电子体的单质分子的路易斯结构式:N≡N:;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮
等有机溶剂.据此判断三氯化铁晶体为分子晶体;
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际
含有的Fe原子个数之比为2:1.
20.下列有关电解质溶液的说法正确的是( )
| A. | 向0.1 mol•L-1CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 在0.l mol•L-1的稀硫酸加水稀释的过程中,c(H+):c(SO42-)始终为2:1 | |
| C. | 向盐酸中加入氨水至中性,溶液中$\frac{c(N{H}_{4}^{+})}{c(c{l}^{-})}$>1 | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
1.对于胃溃疡较重的病人,不适合使用的抑酸剂是( )
| A. | Mg(OH)2 | B. | Al(OH)3 | C. | NaHCO3 | D. | MgCO3 |
 将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应:3A+B?2C,在反应过程中C的物质的量分数随温度变化如图所示:
将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应:3A+B?2C,在反应过程中C的物质的量分数随温度变化如图所示: