题目内容
6.把98%(密度为1.84g•cm3)的浓硫酸稀释成2mol•L-1的稀硫酸100mL,回答下列问题:①需要量取浓硫酸10.9mL;
②配制操作可分解成如下几步,正确的操作顺序是CDBAGFE.
A.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶中,并重复操作两次
B.把已冷却的稀硫酸注入经检查不漏水的容量瓶中
C.根据计算,用量筒量取一定体积的浓硫酸
D.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
E.盖上容量瓶的塞子,振荡,摇匀
F.用胶头滴管滴加蒸馏水,使溶液凹液面恰好与刻度线相切
G.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线.
分析 ①浓H2SO4的物质的量浓度c=$\frac{1000ρw}{M}$,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
②根据配制一定物质的量浓度溶液的配制步骤对各操作进行排序.
解答 解:①该浓H2SO4的物质的量浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制100mL的2mol•L-1溶液,根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=100mL×2mol/L,解得:x≈10.9mL,
故答案为:10.9;
②配制2mol•L-1的稀硫酸100mL的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,所以正确存在顺序为:CDBAGFE,
故答案为:CDBAGFE.
点评 本题考查了配制一定物质的量浓度的溶液的方法,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力,题目难度不大.

练习册系列答案
相关题目
16.下列共价键中,属于非极性键的是( )
| A. | C-H | B. | C-Cl | C. | C═O | D. | N≡N |
17.乙醇分子中各种化学键如图所示.下列有关反应断键位置说明错误的是( )


| A. | 乙醇和浓硫酸,共热到170℃时断键②⑤ | |
| B. | 乙醇和浓硫酸,共热到140℃时断键①④ | |
| C. | 乙醇和金属钠的反应断键① | |
| D. | 乙醇在Cu催化下与O2反应时断键①③ |
1.下列分子式只能表示一种物质的是( )
| A. | C2H4 Br2 | B. | C3H8 | C. | C4H9Cl | D. | C |
11.下列关于反应:XeF4+2CH3-CH=CH2→2CH3CH2CHF2+Xe 说法正确的是( )
| A. | 该反应不属于氧化还原反应 | B. | CH3-CH=CH2发生氧化反应 | ||
| C. | 该反应属于加成反应 | D. | Xe是氧化产物 |

 (R1,R2代表烷基)
(R1,R2代表烷基) (其他产物略)
(其他产物略) .
.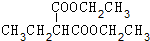 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→ +CH3CH2OH+NaBr.
+CH3CH2OH+NaBr. .
. .
.
 ,下列化合物中,不是2-奈酚的同分异构体的是( )
,下列化合物中,不是2-奈酚的同分异构体的是( )


