题目内容
18.2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛.(1)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理.已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(2)氧化铁是重要工业颜料,下面是制备氧化铁的一种方法,其流程如图:
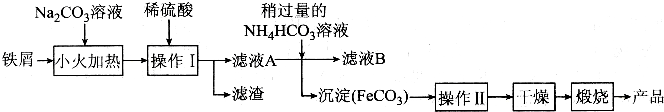
①操作Ⅰ的名称是过滤;操作Ⅱ为洗涤,洗涤操作的具体方法为沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复2-3次;
②滤液A中加入稍过量的NH4HCO3溶液生成沉淀同时有一种气体产生,写出其化学方程式:FeSO4+2NH4 HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O;
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0g氧化铁产品,溶解,在250mL容量瓶中定容;量取25.00mL待测溶液于锥形瓶中,用酸化的0.01000mol/L KMnO4溶液滴定至终点,重复滴定2-3次,消耗KMnO4溶液体积的平均值为20.00mL,
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是c(填字母序号).
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
②计算上述产品中Fe2O3的质量分数为76%.
分析 (1)SO2转化为SO42-该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根离子;
(2)用碳酸钠溶液除去Fe表面的油污,加稀硫酸除去碳酸钠,且溶解Fe,过除去不溶物滤,滤液A中含Fe2+,与碳酸氢铵反应生成碳酸亚铁沉淀,再过滤分离,碳酸亚铁经过洗涤、干燥、煅烧得到氧化铁;
(3)①亚铁离子具有还原性,不能用氧化性酸酸化,酸性高锰酸钾溶液具有强氧化性,不能用盐酸酸化;
②由Fe元素守恒、电子转移守恒可得关系式:5FeO~5Fe2+~KMnO4,结合关系式计算样品中FeO的质量,进而计算氧化铁的质量分数.
解答 解:(1)常温下将SO2转化为SO42-而实现SO2的处理.含SO2的废气通入含Fe2+、Fe3+的溶液时其中一个反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为三价铁离子氧化二氧化硫到硫酸根离子,反应的离子方程式为:2Fe3++SO2+2H20=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(2)用碳酸钠溶液除去Fe表面的油污,加稀硫酸除去碳酸钠,且溶解Fe,过除去不溶物滤,滤液A中含Fe2+,与碳酸氢铵反应生成碳酸亚铁沉淀,再过滤分离,碳酸亚铁经过洗涤、干燥、煅烧得到氧化铁.
①操作Ⅰ是分离互不相溶的固体与液态,应是过滤,操作Ⅱ为洗涤,洗涤操作的具体方法为:沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复2-3次,
故答案为:过滤;沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复2-3次;
②滤液A中含有FeSO4等,加入稍过量的NH4HCO3溶液生成碳酸亚铁沉淀,同时有一种气体产生,该气体为二氧化碳,反应化学方程式:FeSO4+2NH4 HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O,
故答案为:FeSO4+2NH4 HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O;
(3)①亚铁离子具有还原性,硝酸具有强氧化性,不能用硝酸酸化,酸性高锰酸钾溶液具有强氧化性,不能用盐酸酸化,
故选:c;
②由Fe元素守恒、电子转移守恒可得关系式:5FeO~5Fe2+~KMnO4,
设样品中FeO的质量为m,则:
5FeO~5Fe2+~KMnO4
360g 1mol
m×$\frac{25mL}{250mL}$ 0.02L×0.01mol/L
所以 360g:m×$\frac{25mL}{250mL}$=1mol:0.02L×0.01mol/L
解得m=0.72g
则样品中氧化铁的质量分数为$\frac{3g-0.72g}{3g}$×100%=76%,
故答案为:76%.
点评 本题考查物质制备实验、定量测定实验、氧化还原反应、混合物分离提纯、实验基本操作等,需要学生熟练掌握元素化合物知识,明确工艺流程原理,为高考常考题型,是对学生综合能力的考查,题目难度中等.

| A. | 温度计要插入反应混合液中 | |
| B. | 圆底烧瓶中要放入少量碎瓷片 | |
| C. | 圆底烧瓶中注入酒精和稀硫酸的体积为1:3 | |
| D. | 加热时使液体温度迅速升高到170℃ |
| A. | F | B. | C | C. | S | D. | O |
| A. | ${\;}_{53}^{135}$I是碘的一种同素异形体 | |
| B. | ${\;}_{53}^{135}$I是一种新发现的元素 | |
| C. | 它的中子数是53 | |
| D. | 核内的中子数与核外电子数之差为29 |
 2008年北京奥运会火炬以中国传统祥云符号和纸卷轴为创意,由铝合金制成,使用的燃料为丙烷.下列说法不正确的是( )
2008年北京奥运会火炬以中国传统祥云符号和纸卷轴为创意,由铝合金制成,使用的燃料为丙烷.下列说法不正确的是( )| A. | 丙烷与甲烷互为同系物 | |
| B. | 丙烷燃烧是吸热反应 | |
| C. | 铝柄有一层致密的氧化膜可防止其腐蚀 | |
| D. | 火炬燃料用丙烷比用煤油更环保 |
| A. | 溴丙烷和氢氧化钠溶液反应制丙醇;丙烯与水反应制丙醇 | |
| B. | 甲苯硝化制对硝基甲苯;甲苯和高锰酸钾反应制苯甲酸 | |
| C. | 1-氯环己烷制环己烯;丙烯与溴反应制1,2-二溴丙烷 | |
| D. | 苯甲酸乙酯水解制苯甲酸和乙醇;乙酸和乙醇制乙酸乙酯 |

 ,反应类型为水解(取代)反应.
,反应类型为水解(取代)反应. ,反应类型为酯化(取代)反应.
,反应类型为酯化(取代)反应.