题目内容
1.下列排列顺序不正确的是( )| A. | 非金属性:F>Cl>Br | B. | 原子半径:Na>S>F | ||
| C. | 酸性:H2SO4>H3PO4>H4SiO4 | D. | 热稳定性:H2O>HF>H2S |
分析 A.同一主族,原子序数越大非金属性越弱;
B.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小;
C.非金属性越强,最高价氧化物对应水合物的酸性越强;
D.非金属性越强,对应氢化物的稳定性越强.
解答 解:A.F、Cl、Br位于同一主族,原子序数依次增大,则非金属性逐渐增强,所以非金属性:F>Cl>Br,故A正确;
B.F含有2个电子层,Na、S含有3个电子层,则F的原子半径最小,Na、S电子层相同,原子序数Na<S,则原子半径Na>S,所以原子半径大小为:Na>S>F,故B正确;
C.非金属性S>P>Si,则最高价含氧酸的酸性:H2SO4>H3PO4>H4SiO4,故C正确;
D.非金属性:F>O>S,非金属性越强对应氢化物越稳定,则氢化物稳定性:HF>H2O>H2S,故D错误;
故选D.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,明确元素周期律内容为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列关于药物的叙述正确的是( )
| A. | 在饭前服用鱼肝油,更有利于人体吸收药物的有效成分 | |
| B. | 可以用萃取等方法从中草药中提取有效成分 | |
| C. | 患有胃溃疡的患者可用小苏打治疗胃酸过多 | |
| D. | 服用铝膜包装的药品对人体没有任何危害 |
13.下列元素中,原子M层电子数与K层数相同的有( )
| A. | F | B. | Mg | C. | Al | D. | Si |
10.苯甲酸钠(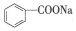 ,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
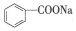 ,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )| A. | 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 | |
| B. | 提高CO2充气压力,饮料中c(A-)不变 | |
| C. | 当pH为5.0时,饮料中$\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| D. | 碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-) |
11.CO和CH4的混合气体若恰好在等体积O2中完全燃烧,则原混合气体中CO和CH4的体积比为( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 3:1 |
 .
.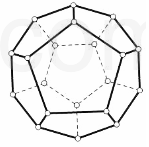 2000 年,德国Freiburg大学的H.Prinzbach宣称,他们通过摘除法,已经在气相质谱仪的气体中发现了最小的球碳分子(富勒烯)--C20(如图所示).然后在电子冲击质谱仪中观察到了微量C20+和C202+的存在. 他将C20H20 溶解在液溴里,在烧瓶里加压长时间回流,最终得到平均组成为 C20HBr13的产物.
2000 年,德国Freiburg大学的H.Prinzbach宣称,他们通过摘除法,已经在气相质谱仪的气体中发现了最小的球碳分子(富勒烯)--C20(如图所示).然后在电子冲击质谱仪中观察到了微量C20+和C202+的存在. 他将C20H20 溶解在液溴里,在烧瓶里加压长时间回流,最终得到平均组成为 C20HBr13的产物.