题目内容
18.A元素原子的原子序数为16.B元素与A元素原子核外电子层数相同,B元素原子的最外电子层上只有1个电子.(1)A、B元素形成的化合物是硫化钠.
(2)B原子的结构示意图为
 .
.
分析 A元素原子的原子序数为16,A为S元素;B元素与A元素的原子核外电子层数相同,S位于第三周期,则B均为第三周期元素,B元素的原子最外电子层只有1个电子,则B的质子数为11,B为Na元素,以此来解答.
解答 解:(1)A、B分别为S、Na元素,两元素形成的化合物的名称是硫化钠,故答案为:硫化钠;
(2)B为Na元素,其原子序数=核电荷数=11,最外层含有1个电子,则Na元素的原子结构示意图为 ,故答案为:
,故答案为: .
.
点评 本题考查原子结构,为高频考点,题目难度不大,把握电子排布规律推断元素为解答的关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题侧重分析与推断能力的考查.

练习册系列答案
相关题目
9.浓硫酸能与碳反应,是因为浓硫酸具有( )
| A. | 强酸性 | B. | 脱水性 | C. | 强氧化性 | D. | 吸水性 |
13.下列物质的颜色叙述正确的是( )
| A. | Fe2O3-黑色 | B. | MgO-白色 | ||
| C. | FeCl3溶液-红褐色 | D. | Fe(OH)2-灰绿色 |
10.下列金属冶炼的反应原理,错误的是( )
| A. | 2NaCl(熔融)$\stackrel{通电}{→}$ 2Na+Cl2↑ | B. | MgO+H2$\stackrel{△}{→}$Mg+H2O | ||
| C. | Fe3O4+4CO3$\stackrel{高温}{→}$Fe+4CO2 | D. | 2HgO 2$\stackrel{△}{→}$Hg+O2↑ |
1.下列排列顺序不正确的是( )
| A. | 非金属性:F>Cl>Br | B. | 原子半径:Na>S>F | ||
| C. | 酸性:H2SO4>H3PO4>H4SiO4 | D. | 热稳定性:H2O>HF>H2S |




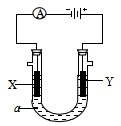 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: $\stackrel{H_{2}O}{→}$
$\stackrel{H_{2}O}{→}$
 $\stackrel{2H}{→}$
$\stackrel{2H}{→}$ ,失去的氢原子再和氧原子结合成水分子
,失去的氢原子再和氧原子结合成水分子 +$\stackrel{O_{2}}{→}$
+$\stackrel{O_{2}}{→}$ $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$ 反应过程中为先加氧后脱水
反应过程中为先加氧后脱水