题目内容
16.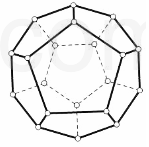 2000 年,德国Freiburg大学的H.Prinzbach宣称,他们通过摘除法,已经在气相质谱仪的气体中发现了最小的球碳分子(富勒烯)--C20(如图所示).然后在电子冲击质谱仪中观察到了微量C20+和C202+的存在. 他将C20H20 溶解在液溴里,在烧瓶里加压长时间回流,最终得到平均组成为 C20HBr13的产物.
2000 年,德国Freiburg大学的H.Prinzbach宣称,他们通过摘除法,已经在气相质谱仪的气体中发现了最小的球碳分子(富勒烯)--C20(如图所示).然后在电子冲击质谱仪中观察到了微量C20+和C202+的存在. 他将C20H20 溶解在液溴里,在烧瓶里加压长时间回流,最终得到平均组成为 C20HBr13的产物.(1)C20的空间构型是正十二面体,其中 C-C σ键数是30,键角是108°;
(2)C202+中存在的π键数是9;
(3)C20H20分子中 C 原子杂化类型是sp3杂化,H-C-C 键角比 C-C-C 键角大(填“大”、“小”或“相等”),C20H20中 C-C σ键长比 C20中长(填“长”、“短”或“相等”);
(4)如果我们将C20HBr13看成唯一的有机产物,请配平下列方程式:
C20H20+Br2 $\stackrel{催化剂}{→}$C20HBr13+19HBr.
分析 (1)根据晶胞的结构结合均摊法进行计算,共有20个点,每5个点构成一正五边形,C20的空间构型是正十二面体,分子中平均每个碳原子形成的棱为$\frac{3}{2}$,碳为四价,n(单键)+n(双键)=n(棱边数),正五边形内角为108°;
(2)碳碳双键中含有1个π键,C202+为C20失去2个电子形成的阳离子;
(3)根据分子的组成判断形成的δ键数目以及孤电子对数目,以此判断杂化类型,根据烷烃、正五边形比较键角,H-C-C 键角比 C-C-C 键角大,C20H20中 C-C σ键长比 C20中长;
(4)根据化学反应前后原子守恒可知,另一种产物为溴化氢.
解答 解:(1)根据图示晶胞的结构可知,共有20个点,每5个点构成一正五边形,每个点被三个面共用,C20的面数为$\frac{20×3}{5}$=12,C20的空间构型是正十二面体,每个点被三个面共用,分子中平均每个碳原子形成的棱为$\frac{3}{2}$,棱数为:$\frac{3}{2}$×2=30,碳为四价,n(单键)+n(双键)=30(棱边数),根据碳原子的连接方式可得n(双键)=20÷2=10,n(单键)=30-10=20,碳碳双键中含有一单键,所以C-C σ键数是=20+10=30,组成正五边形,正五边形内角为键角,键角为108°,
故答案为:十二;30;108°;
(2)C202+为C20失去2个电子形成的阳离子,相对于C20少一个双键,C20含有9个双键,因此C202+中存在的π键数是9,
故答案为:9;
(3)C20H20分子相当于C20中的双键与氢气加成,全部变为单键,则分子中C原子含有4个σ键电子对,没有孤电子对,碳原子的杂化为sp3杂化,C-C-C 为正五边形的内角,而H-C-C 键角类似烷烃的中碳氢夹角,所以比 C-C-C 键角大,C20H20中 C-C σ键长比 C20中长,
故答案为:sp3;大;长;
(4)根据化学反应前后原子守恒可知,另一种产物为溴化氢,化学方程式为:C20H20+16Br2 $\stackrel{催化剂}{→}$C20HBr13+19HBr,
故答案为:C20H20+16Br2 $\stackrel{催化剂}{→}$C20HBr13+19HBr.
点评 本题考查物质结构有关知识,掌握均摊法是解答关键,注意掌握杂化类型的判断方法,为高频考点,题目难度中等.

| A. | Fe2O3-黑色 | B. | MgO-白色 | ||
| C. | FeCl3溶液-红褐色 | D. | Fe(OH)2-灰绿色 |
 中,在同一平面上碳原子最多有几个,在同一直线上的碳原子最多有几个( )
中,在同一平面上碳原子最多有几个,在同一直线上的碳原子最多有几个( )| A. | 11、4 | B. | 13、3 | C. | 13、4 | D. | 12、3 |
| A. | 非金属性:F>Cl>Br | B. | 原子半径:Na>S>F | ||
| C. | 酸性:H2SO4>H3PO4>H4SiO4 | D. | 热稳定性:H2O>HF>H2S |
| A. | 蓝色硫酸铜 | B. | 液体浓硫酸 | C. | 无水氯化钙 | D. | 白色碱石灰 |

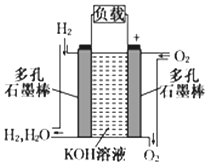 被誉为改变未来世界十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: ;
;