题目内容
10. 磷单质及其化合物在工业生产中有着广泛的应用.白磷可用于制备高纯度的磷酸(
磷单质及其化合物在工业生产中有着广泛的应用.白磷可用于制备高纯度的磷酸(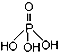 ),三聚磷酸钠(NaH2PO2)可用于化学镀镍等等.请回答下列问题:
),三聚磷酸钠(NaH2PO2)可用于化学镀镍等等.请回答下列问题:(1)磷原子的价电子排布式为3s2p3;
(2)NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为H<O<P<Na.
(3)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,其中某种多聚磷酸根的结构如图所示.则P原子的杂化类型为sp3杂化,这种多聚磷酸钠的化学式为Na5P3O10.
分析 (1)P原子处于第三周期VA族;
(2)所有元素中H原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大;
(3)多聚磷酸根中P原子形成σ键、没有孤对电子,杂化轨道数目为4;O元素为-2价、P元素为+5价,可知原子团化合价为-5.
解答 解:(1)P原子处于第三周期VA族,价电子排布式为:3s2p3,
故答案为:3s2p3;
(2)所有元素中H原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:H<O<P<Na,
故答案为:H<O<P<Na;
(3)多聚磷酸根中P原子形成σ键、没有孤对电子,杂化轨道数目为4,P原子采取sp3杂化;O元素为-2价、P元素为+5价,可知原子团化合价为(+5)×3+10×(-2)=-5,故这种多聚磷酸钠的化学式为Na5P3O10,
故答案为:sp3杂化;Na5P3O10.
点评 本题考查核外电子排布、微粒半径比较、杂化方式判断等,难度不大,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
20.下列对有关实验事实的说明或解释正确的是( )
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度都会降低,但原理不相同 | |
| B. | 常温下,浓硫酸可以用铁制容器储存,说明铁与冷的浓硫酸不反应 | |
| C. | 向某溶液中加入盐酸酸化的氯化钡溶液,生成白色沉淀,说明原溶液中一定含有SO42- | |
| D. | 向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中一定含有Fe2+ |
1.下列表示对应化学反应的离子方程式正确的是( )
| A. | 氧化铜与稀硫酸反应:O2-+2H+═H2O | |
| B. | Na投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 铜与浓硝酸的反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 氢氧化钡与稀硫酸的反应:H++2SO42-+2Ba2++OH-═2BaSO4↓+H2O |
18.下列不属于金属单质共性的是( )
| A. | 导电性 | B. | 延展性 | C. | 高熔点 | D. | 金属光泽 |
5.下列有机物的命名正确的是( )
| A. | CH≡C一CH2CH3 丁炔 | B. | CH2=CH-CH=CH-CH3 1,3-二戊烯 | ||
| C. | 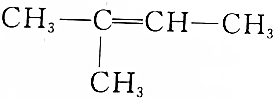 2-甲基丁烯 | D. | 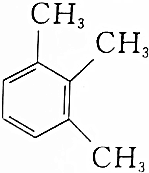 1,2,3-三甲苯 |
15.下列物质属于共价化合物的是( )
| A. | 氯气 | B. | 氨气 | C. | 氯化钠 | D. | 氧化镁 |
2.在化学学习中经常采用推理的思维方法,下列推理正确的是( )
| A. | 加热蒸发食盐水可以得到 NaCl 晶体,加热蒸发 AlCl 3 溶液也可以得到 AlCl 3 晶体 | |
| B. | 配制浓度均为 0.1mol•L-1 的H3PO4 和 H2SO4 溶液,分别测其pH,若 H3PO 4溶液的pH大于 H2SO4 溶液的pH,可推出非金属性:S>P | |
| C. | NaHCO3 溶液中滴入酚酞显红色,NaHSO4 溶液中滴入酚酞也显红色 | |
| D. | 钠在氧气中燃烧生成过氧化钠,和钠同主族的锂在氧气中燃烧也生成过氧化锂 |
19.关于铁的叙述正确的是( )
| A. | 铁能被磁体吸引,纯铁易生锈 | |
| B. | FeCl2可以通过铁与氯气的化合反应得到 | |
| C. | 缺铁性贫血里的铁是指铁元素 | |
| D. | 工业上常用铁矿石与氢气在高炉内反应来炼铁 |