题目内容
2.在化学学习中经常采用推理的思维方法,下列推理正确的是( )| A. | 加热蒸发食盐水可以得到 NaCl 晶体,加热蒸发 AlCl 3 溶液也可以得到 AlCl 3 晶体 | |
| B. | 配制浓度均为 0.1mol•L-1 的H3PO4 和 H2SO4 溶液,分别测其pH,若 H3PO 4溶液的pH大于 H2SO4 溶液的pH,可推出非金属性:S>P | |
| C. | NaHCO3 溶液中滴入酚酞显红色,NaHSO4 溶液中滴入酚酞也显红色 | |
| D. | 钠在氧气中燃烧生成过氧化钠,和钠同主族的锂在氧气中燃烧也生成过氧化锂 |
分析 A、氯化铝属于强酸弱碱盐,水解生成Al(OH)3和HCl,加热促进水解;
B、H3PO4是三元酸,而H2SO4是二元酸;
C、NaHCO3的是强碱弱酸盐,既能水解又能电离;而NaHSO4是强碱强酸盐,只能电离不能水解;
D、锂不如钠活泼.
解答 解:A、氯化铝属于强酸弱碱盐,水解生成Al(OH)3和HCl,加热促进水解,所以加热蒸发AlCl3溶液可不能获得AlCl3(s),故A错误;
B、H3PO4是三元酸,而H2SO4是二元酸,故浓度均为 0.1mol•L-1 的H3PO4 和 H2SO4 溶液,能说明酸性H3PO4 弱于H2SO4,而最高价含氧酸的酸性越弱,则元素的非金属性越弱,故非金属性P弱于S,故B正确;
C、NaHCO3的是强碱弱酸盐,既能水解又能电离,且水解大于电离,故溶液显碱性,滴入酚酞变红;而NaHSO4是强碱强酸盐,只能电离不能水解,故溶液显强酸性,滴入酚酞无现象,故C错误;
D、锂不如钠活泼,而金属越活泼,燃烧的产物越复杂,故钠燃烧生成过氧化钠,而锂燃烧只能生成氧化锂,故D错误.
故选B.
点评 本题考查了盐类水解的应用、非金属性强弱的比较和碱金属单质燃烧的产物等问题,难度不大,但综合性较强.

练习册系列答案
相关题目
17.根据反应:2Fe+3Cl2$\stackrel{△}{→}$2FeCl3,当28gFe在71gCl2中点燃时( )
| A. | Fe和Cl2恰好完全反应 | B. | 生成99gFeCl3 | ||
| C. | 会有9.33gFe过量 | D. | 会有17.75gCl2过量 |
14.下列分散系属于液溶胶体的是( )
| A. | 氯化铁溶液 | B. | 雾 | C. | 玻璃 | D. | 蛋白质溶液 |
12.下列说法正确的是( )
| A. | 糖类、油脂和蛋白质都是高分子化合物 | |
| B. | 乙醇和乙酸都能与金属钠反应生成氢气 | |
| C. | 淀粉(C6H10O5)n和纤维素(C6H10O5)n互为同分异构体 | |
| D. | 石油的分馏和煤的干馏均只发生物理变化 |


 .
. .
. (写出其中一种结构简式)
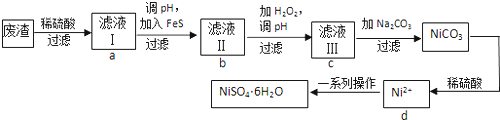
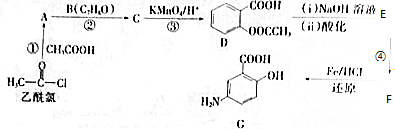
(写出其中一种结构简式)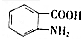 的流程图(无机试剂任选).合成路线流程图如下:
的流程图(无机试剂任选).合成路线流程图如下: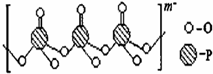 磷单质及其化合物在工业生产中有着广泛的应用.白磷可用于制备高纯度的磷酸(
磷单质及其化合物在工业生产中有着广泛的应用.白磷可用于制备高纯度的磷酸(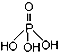 ),三聚磷酸钠(NaH2PO2)可用于化学镀镍等等.请回答下列问题:
),三聚磷酸钠(NaH2PO2)可用于化学镀镍等等.请回答下列问题: A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中 B与C同周期,D与E、F同周期,A与D 同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中 B与C同周期,D与E、F同周期,A与D 同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.