题目内容
下列说法正确的是( )
| A、一定温度下,某溶液的pH<7,则该溶液呈酸性 |
| B、在水中加入少量碳酸钠固体将抑制水的电离 |
| C、0.02mol?L-1CH3COOH溶液和0.01mol?L-1NaOH溶液等体积混合,则溶液中:2c(H+)+c(CH3COOH)=2 c(OH-)+c(CH3COO-) |
| D、浓度均为0.1mol/L的NH4Cl溶液和NH4HSO4溶液,前者的c(NH4+)大于后者 |
考点:酸碱混合时的定性判断及有关ph的计算,水的电离,影响盐类水解程度的主要因素
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.水的离子积受温度的影响,没有告诉温度,则pH<6的溶液不一定为酸性溶液;
B.碳酸根离子结合水电离的氢离子,促进了水的电离;
C.0.02mol?L-1CH3COOH溶液和0.01mol?L-1NaOH溶液等体积混合,混合液为等浓度的醋酸和醋酸钠,根据混合液中的物料守恒和电荷守恒进行解答;
D.硫酸氢铵溶液中,氢离子抑制了铵根离子的电离,则氯化铵溶液中铵根离子浓度小于硫酸氢铵中铵根离子浓度.
B.碳酸根离子结合水电离的氢离子,促进了水的电离;
C.0.02mol?L-1CH3COOH溶液和0.01mol?L-1NaOH溶液等体积混合,混合液为等浓度的醋酸和醋酸钠,根据混合液中的物料守恒和电荷守恒进行解答;
D.硫酸氢铵溶液中,氢离子抑制了铵根离子的电离,则氯化铵溶液中铵根离子浓度小于硫酸氢铵中铵根离子浓度.
解答:
解:A.常温下,水的离子积Kw=1×10-14,所以常温下pH<7,溶液呈酸性,而100℃时,水的离子积常数是10-12,当pH=6时溶液呈中性,所以pH<6的溶液一定显酸性错误,故A错误;
B.在水中加入少量碳酸钠固体,碳酸钠电离出的碳酸根离子发生水解,促进了水的电离,导致水的电离程度增大,故B错误;
C.0.02mol?L-1CH3COOH溶液和0.01mol?L-1NaOH溶液等体积混合后,溶质为等浓度的醋酸和醋酸钠,混合液显酸性,根据电荷守恒可得:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒可知:c(CH3COO-)+c(CH3COOH)=0.01mol/L=2c(Na+),由上述两个式子可得:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),故C正确;
D.浓度均为0.1mol/L的NH4Cl溶液和NH4HSO4溶液,由于硫酸氢铵电离的氢离子抑制了氢离子的电离,导致硫酸氢铵溶液中铵根离子浓度较大,则前者的c(NH4+)小于后者,故D错误;
故选C.
B.在水中加入少量碳酸钠固体,碳酸钠电离出的碳酸根离子发生水解,促进了水的电离,导致水的电离程度增大,故B错误;
C.0.02mol?L-1CH3COOH溶液和0.01mol?L-1NaOH溶液等体积混合后,溶质为等浓度的醋酸和醋酸钠,混合液显酸性,根据电荷守恒可得:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒可知:c(CH3COO-)+c(CH3COOH)=0.01mol/L=2c(Na+),由上述两个式子可得:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),故C正确;
D.浓度均为0.1mol/L的NH4Cl溶液和NH4HSO4溶液,由于硫酸氢铵电离的氢离子抑制了氢离子的电离,导致硫酸氢铵溶液中铵根离子浓度较大,则前者的c(NH4+)小于后者,故D错误;
故选C.
点评:本题考查了水的离子积及其影响、酸碱混合的定性判断、离子浓度定性比较,题目难度中等,注意掌握酸碱混合的定性判断方法,明确离子浓度定性比较方法,学会电荷守恒、物料守恒、盐的水解原理等知识在比较离子浓度大小中的应用方法.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
下列与有机物相关的叙述正确的是( )
| A、CH4O与C2H6O一定互为同系物 |
| B、1mol C6H6(苯)中含有3mol碳碳双键 |
| C、用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质 |
| D、向乙酸乙酯中加入NaOH 溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸 |
下列说法不正确的是( )
| A、在NaHCO3溶液中有:C(CO32-)+C(OH-)=C(H+)+C(H2CO3) |
| B、FeCl3溶液中存在:Fe3++3H2O?Fe(OH)3+3H+ 的水解平衡,给该溶液里加少量HCl或NaOH溶液,都能使该平衡向左移动 |
| C、乙酸乙酯的制取实验中,试剂加入的顺序是:无水乙醇→浓硫酸→冰醋酸 |
| D、实验室制取甲烷的原理是:无水醋酸钠和碱石灰共热,其中碱石灰的成分是NaOH和CaO |
下列对有机物结构或性质的描述,错误的是( )
| A、一定条件下,C12可在甲苯的苯环或侧链上发生取代反应 |
B、2-甲基丙烯的结构简式: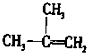 |
| C、乙醇和乙烯的混合物l mol,完全燃烧消耗3 mol O2 |
| D、光照下2,2-二甲基丁烷与Br2反应,其一溴取代物只有2种 |
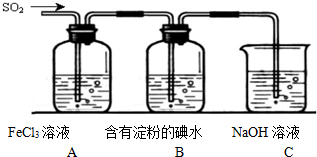
 FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题: