题目内容
常温下,下列叙述不正确的是( )
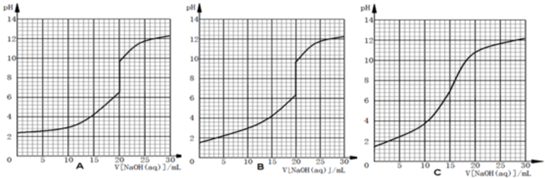
| A、在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a<b |
| B、在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH<8.0 |
| D、若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11 |
考点:pH的简单计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.根据弱电解质的电离平衡来分析稀释后的pH;
B.酚酞的变色范围是pH:8.0~10.0;
C.根据PH=-lgC(H+)以及常温下酸溶液的pH一定小于7来分析;
D.根据酸碱混合及溶液的pH=7来分析NaOH溶液的pH;
B.酚酞的变色范围是pH:8.0~10.0;
C.根据PH=-lgC(H+)以及常温下酸溶液的pH一定小于7来分析;
D.根据酸碱混合及溶液的pH=7来分析NaOH溶液的pH;
解答:
解:A.因醋酸是弱电解质,稀释时促进电离,但氢离子的浓度减小,则pH变大,即b>a,故A正确;
B.酚酞的变色范围是pH=8.0~10.0(无色→红色),在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,pH不一定小于7,可能在7~8之间,故B错误;
C.PH=-lgC(H+),1.0×10-3mol/L盐酸的pH=3.0,因常温下,中性溶液的pH=7,则酸的pH一定小于7,即1.0×10-8mol/L盐酸的pH<8.0,故C正确;
D.因酸碱混合后pH=7,即恰好完全反应,设碱的浓度为c,则1×0.1mol/L=100×c,c=0.001mol/L,则NaOH溶液的PH=11,故D正确;
故选B.
B.酚酞的变色范围是pH=8.0~10.0(无色→红色),在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,pH不一定小于7,可能在7~8之间,故B错误;
C.PH=-lgC(H+),1.0×10-3mol/L盐酸的pH=3.0,因常温下,中性溶液的pH=7,则酸的pH一定小于7,即1.0×10-8mol/L盐酸的pH<8.0,故C正确;
D.因酸碱混合后pH=7,即恰好完全反应,设碱的浓度为c,则1×0.1mol/L=100×c,c=0.001mol/L,则NaOH溶液的PH=11,故D正确;
故选B.
点评:本题考查弱电解质的电离,易错选项是C,注意:酸或碱稀释过程中溶液接近中性时,要考虑水的电离,为易错点,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法不正确的是( )
| A、在NaHCO3溶液中有:C(CO32-)+C(OH-)=C(H+)+C(H2CO3) |
| B、FeCl3溶液中存在:Fe3++3H2O?Fe(OH)3+3H+ 的水解平衡,给该溶液里加少量HCl或NaOH溶液,都能使该平衡向左移动 |
| C、乙酸乙酯的制取实验中,试剂加入的顺序是:无水乙醇→浓硫酸→冰醋酸 |
| D、实验室制取甲烷的原理是:无水醋酸钠和碱石灰共热,其中碱石灰的成分是NaOH和CaO |
下列对有机物结构或性质的描述,错误的是( )
| A、乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O |
| B、光照下2,2-二甲基丙烷与Br2蒸气反应,其一溴取代物只有一种 |
C、某有机物球棍结构模型如右图,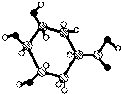 则该有机物能发生消去反应和氧化反应 则该有机物能发生消去反应和氧化反应 |
| D、二十碳五烯酸和二十二碳六烯酸是鱼油的主要成分,它们含有相同的官能团,是同系物,化学性质相似 |
下列各图所示装置,肯定不符合气密性要求的是( )
A、 |
B、 |
C、 |
D、 |
下列叙述不正确的是( )
| A、纯银器表面在空气中因化学腐蚀渐渐变暗 |
| B、氢氧燃料电池是一种将化学能转化为电能的装置 |
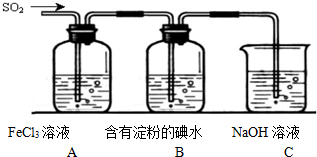
| C、可用浸有酸性高锰酸钾溶液的滤纸来检验二氧化硫气体的漂白性 |
| D、塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解 |