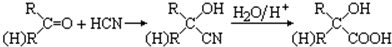
题目内容
Ⅰ.实验室有一瓶失去标签的某白色固体X,已知其成分可能是碳酸或亚硫酸的钠盐或钾盐,且成分单一.现某化学小组通过如下步骤来确定其成分:
(1)阳离子的确定
实验方法及现象: .
结论:此白色固体是钠盐.
(2)阴离子的确定
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色.
②要进一步确定其成分需继续进行如下实验:取适量白色固体配成溶液,取少许该溶液于试管中,加入BaCl2溶液,出现白色沉淀.
Ⅱ.确认其成分后,由于某些原因,该白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤①:称取样品1.000g.
步骤②:将样品溶解后完全转移到250mL容量瓶中,定容,充分摇匀.
步骤③:移取25.00mL样品溶液于250mL锥形瓶中,用0.01mol?L-1 KMnO4标准溶液滴定至终点.
按上述操作方法再重复2次.
(1)写出步骤③所发生反应的离子方程式: .
(2)在配制0.01mol?L-1 KMnO4溶液定容时若仰视,则最终测得变质固体中X的含量 (填“偏大”、“偏小”或“无影响”).
(3)滴定结果如表所示:
则该变质固体中X的质量分数为 .
(1)阳离子的确定
实验方法及现象:
结论:此白色固体是钠盐.
(2)阴离子的确定
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色.
②要进一步确定其成分需继续进行如下实验:取适量白色固体配成溶液,取少许该溶液于试管中,加入BaCl2溶液,出现白色沉淀.
Ⅱ.确认其成分后,由于某些原因,该白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤①:称取样品1.000g.
步骤②:将样品溶解后完全转移到250mL容量瓶中,定容,充分摇匀.
步骤③:移取25.00mL样品溶液于250mL锥形瓶中,用0.01mol?L-1 KMnO4标准溶液滴定至终点.
按上述操作方法再重复2次.
(1)写出步骤③所发生反应的离子方程式:
(2)在配制0.01mol?L-1 KMnO4溶液定容时若仰视,则最终测得变质固体中X的含量
(3)滴定结果如表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
考点:几组未知物的检验,中和滴定
专题:物质检验鉴别题,实验设计题
分析:Ⅰ、(1)含有钠元素的物质焰色反应显黄色;
Ⅱ、(1)高锰酸钾具有氧化性,能将亚硫酸根离子氧化为硫酸根离子,本身被还原为锰离子,据此书写离子方程式;
(2)配制0.01mol?L-1 KMnO4溶液定容时若仰视,加水量会偏多,浓度偏小,根据反应的实质来回答;
(3)根据反应2MnO4-+5SO32-+6H+═2Mn2++5SO42-+3H2O得到2MnO4-~5SO32-,根据关系式进行计算即可.
Ⅱ、(1)高锰酸钾具有氧化性,能将亚硫酸根离子氧化为硫酸根离子,本身被还原为锰离子,据此书写离子方程式;
(2)配制0.01mol?L-1 KMnO4溶液定容时若仰视,加水量会偏多,浓度偏小,根据反应的实质来回答;
(3)根据反应2MnO4-+5SO32-+6H+═2Mn2++5SO42-+3H2O得到2MnO4-~5SO32-,根据关系式进行计算即可.
解答:
解:Ⅰ.(1)证明此白色固体是钠盐,即含有的阳离子是钠离子,可以取固体少许制成溶液,进行焰色反应实验,焰色为黄色,即可以证明是钠盐,
故答案为:取固体少许制成溶液,进行焰色反应实验,焰色为黄色;
Ⅱ.(1)高锰酸钾具有氧化性,能将亚硫酸根离子氧化为硫酸根离子,本身被还原为锰离子,即2MnO4-+5SO32-+6H+═2Mn2++5SO42-+3H2O,
故答案为:2MnO4-+5SO32-+6H+═2Mn2++5SO42-+3H2O;
(2)配制0.01mol?L-1 KMnO4溶液定容时若仰视,加水量会偏多,浓度偏小,所以在滴定亚硫酸钠的过程中,消耗的高锰酸钾的量增多,最终测得变质固体中X的含量会增大,故答案为:偏大;
(3)实验结果表明,固体物质是亚硫酸钠,三次滴定消耗高锰酸钾的体积分别是:21.03mL-1.02mL=20.01mL,21.99mL-2.00mL=19.99mL,20.20mL-2.20mL=18.00mL,最后数据误差较大,删去,消耗高锰酸钾的体积是:
=20.00mL,
根据反应2MnO4-+5SO32-+6H+═2Mn2++5SO42-+3H2O,设亚硫酸盐的物质的量是n,得到
2MnO4-~5SO32-,
2 5
0.02L×0.01mol?L-1 n
n=
=5×10-4mol,该变质固体中亚硫酸钠的质量分数为
×100%=63%,故答案为:63%.
故答案为:取固体少许制成溶液,进行焰色反应实验,焰色为黄色;
Ⅱ.(1)高锰酸钾具有氧化性,能将亚硫酸根离子氧化为硫酸根离子,本身被还原为锰离子,即2MnO4-+5SO32-+6H+═2Mn2++5SO42-+3H2O,
故答案为:2MnO4-+5SO32-+6H+═2Mn2++5SO42-+3H2O;
(2)配制0.01mol?L-1 KMnO4溶液定容时若仰视,加水量会偏多,浓度偏小,所以在滴定亚硫酸钠的过程中,消耗的高锰酸钾的量增多,最终测得变质固体中X的含量会增大,故答案为:偏大;
(3)实验结果表明,固体物质是亚硫酸钠,三次滴定消耗高锰酸钾的体积分别是:21.03mL-1.02mL=20.01mL,21.99mL-2.00mL=19.99mL,20.20mL-2.20mL=18.00mL,最后数据误差较大,删去,消耗高锰酸钾的体积是:
| 20.01mL+19.99mL |
| 2 |
根据反应2MnO4-+5SO32-+6H+═2Mn2++5SO42-+3H2O,设亚硫酸盐的物质的量是n,得到
2MnO4-~5SO32-,
2 5
0.02L×0.01mol?L-1 n
n=
| 0.02L×0.01mol/L×5 |
| 2 |
| 5×10-4mol×10×126g/mol |
| 1.00g |
点评:本题考查学生离子的检验以及滴定实验的有关计算知识,注意知识的归纳和梳理是关键,难度较大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
下面是人们对于化学科学的各种常见认识,其中错误的是( )
| A、化学面对现代日益严重的环境问题显得无能为力 |
| B、化学将为能源、资源的合理开发和安全应用做出重大贡献 |
| C、化学是一门实用性很强的科学 |
| D、化学是一门以实验为基础的自然科学 |
下列有关铁丝在氯气中燃烧的说法中正确的是( )
| A、剧烈燃烧,产生大量白烟 |
| B、产生棕红色的浓烟 |
| C、产生苍白色的火焰 |
| D、产物溶于水,溶液呈浅绿色 |
 某学生在实验室做气体发生、洗涤、干燥、收集(不考虑尾气的处理)实验,装置图如图示.该同学所做的实验是( )
某学生在实验室做气体发生、洗涤、干燥、收集(不考虑尾气的处理)实验,装置图如图示.该同学所做的实验是( )| A、锌和盐酸反应制取氢气 |
| B、二氧化锰和浓盐酸反应制取氯气 |
| C、碳酸钙和盐酸反应制取二氧化碳 |
| D、过氧化钠和水反应制取氧气 |