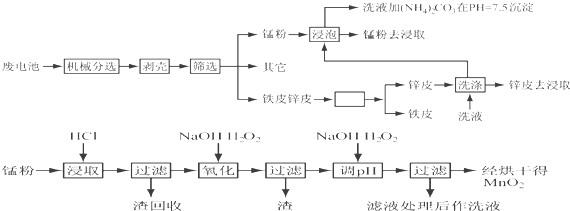
题目内容
已知:S2-、SO32-、NH4-、Al3+、HPO42-、Na+、SO42-、AlO2-、Fe3+、HCO3-、Cl-等离子,按要求填空:
(1)在水溶液中,离子水解呈碱性的是 ;
(2)在水溶液中,离子水解呈酸性的是 ;
(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有 .
(1)在水溶液中,离子水解呈碱性的是
(2)在水溶液中,离子水解呈酸性的是
(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有
考点:离子共存问题
专题:
分析:弱酸根离子水解显碱性;
弱碱阳离子水解显酸性;
既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子,是和氢离子、氢氧根离子都不反应的离子.
弱碱阳离子水解显酸性;
既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子,是和氢离子、氢氧根离子都不反应的离子.
解答:
解:(1)S2-、SO32-、HPO42-、AlO2-、HCO3-属于弱酸根离子,水解显碱性,故答案为:S2-、SO32-、HPO42-、AlO2-、HCO3-;
(2)NH4+、Al3+、Fe3+,属于弱碱阳离子,水解显酸性,故答案为:NH4+、Al3+、Fe3+;
(3)既能在酸性较强溶液里、又能在碱性较强的溶液里大量存在的离子,是和氢离子、氢氧根离子都不反应的离子,强酸的酸根离子和强碱的阳离子,为Na+、SO42-、Cl-,故答案为:Na+、SO42-、Cl-.
(2)NH4+、Al3+、Fe3+,属于弱碱阳离子,水解显酸性,故答案为:NH4+、Al3+、Fe3+;
(3)既能在酸性较强溶液里、又能在碱性较强的溶液里大量存在的离子,是和氢离子、氢氧根离子都不反应的离子,强酸的酸根离子和强碱的阳离子,为Na+、SO42-、Cl-,故答案为:Na+、SO42-、Cl-.
点评:本题考查了离子性质和离子检验,明确盐类水解的实质和离子的性质是解题关键,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
下列反应的离子方程式书写正确的是( )
A、NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3-+2OH-
| ||||
| B、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | ||||
| C、酸性高锰酸钾溶液与双氧水反应:2MnO4-+H2O2+6H+═2Mn2++3O2↑+4H2O | ||||
| D、碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH═Ca2++2CH3COO-+2CO2↑+2H2O |
已知:H2C2O4、KMnO4、H2SO4混合发生反应:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.某同学根据上述原理和溶液褪色时间,设计实验测定反应速率,实验记录如下表(各实验均在室温下进行):下列结论正确的是( )
| 实验编号 | 烧杯中所加的试剂及其用量(mL) | 加入少 量固体 | 溶液褪色 时间(s) | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L 稀硫酸 | |||
| 1 | 30.0 | 20.0 | 30.0 | 20.0 | 无 | 1.8 |
| 2 | 15.0 | 15.0 | 10.0 | 无 | 3.6 | |
| 3 | 30.0 | 20.0 | 30.0 | 20.0 | K2SO4 | 1.8 |
| 4 | 30.0 | 20.0 | 30.0 | 20.0 | MnSO4 | 0.6 |
| A、实验3、4说明K+对该反应有催化作用 |
| B、实验2中x=10 |
| C、实验1、2说明反应速率只与KMnO4浓度有关 |
| D、实验1、4可推出实验1中反应速率变化:起初较小,后明显变大,又逐渐变小 |
现有X、Y、Z、W四种元素,彼此问能发生如下反应:2Y-+W2=2W-+Y2;2Y-+X2=2X-+Y2 ;2W-+X2=2X-+W2 ;2X-+Z2=2Z-+X2 ;其中氧化剂的氧化能力由强到弱的顺序是( )
| A、X2>Y2>Z2>W2 |
| B、Y2>W2>X2>Z2 |
| C、Z2>X2>W2>Y2 |
| D、W2>X2>Z2>Y2 |
如图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述正确的是( )
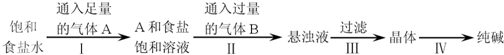

| A、A气体是CO2,B气体是NH3 |
| B、第Ⅲ步得到的晶体是Na2CO3?10H2O |
| C、第Ⅱ步的离子方程式为Na++NH3?H2O+CO2═NaHCO3↓+NH4+ |
| D、第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下: