题目内容
10.高炉气中含有的气体主要有N2、CO、CO2等.在含有大量N2的高炉气体系中,富集CO的技术关键在于要有对CO选择性好的吸附材料,从而实现CO和N2的分离.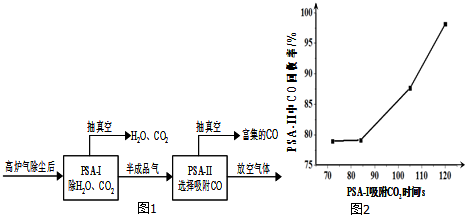
(1)由CO可以直接合成许多C1化工产品,如生产甲醇.已知:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
又知CO(g)燃烧热△H=-283kJ•mol-1,则CO(g)+2H2(g)=CH3OH(l)△H=-121.8kJ•mol-1.
(2)工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的化学方程式如下:
CH3COOCu(NH3)2 (aq)+CO(g)?CH3COOCu(NH3)2•CO(aq)△H<0
吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的措施有ad.
a.适当升高温度 b.适当降低温度 c.增大压强 d.减小压强
(3)到目前为止,CO吸附剂的开发大多数以铜(+1)为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO.图1是变压吸附回收高炉气中CO的流程图.
①PSA-Ⅰ吸附CO2时间对PSA-Ⅱ中CO回收率的影响见图2,由此可见,为了保证载铜吸附剂对CO的吸附和提纯要求,应采取的措施是尽量在PSA-I中将CO2 脱除(保证PSA-I吸附CO2的时间).
②从PSA-Ⅱ中富集得到的CO有广泛的用途,除生产甲醇外,列举其中一种用途作燃料.
③检验放空气体中是否含有CO的实验 操作是:将该气体通入氯化钯(PdCl2)溶液中,观察是否有黑色的单质钯生成,写出对应的化学方程式CO+PdCl2+H2O═Pd↓+2HCl+CO2.
分析 (1)CO(g)燃烧热△H=-283kJ•mol-1,依据燃烧热概念书写热化学方程式,结合2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,和盖斯定律计算得到CO(g)+2H2(g)=CH3OH(l)反应的热化学方程式;
(2)吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,平衡逆向进行,结合平衡移动原理分析选项;
(3)①CO吸附剂的开发大多数以铜(+1)为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO,图象方向可知时间越长CO回收率越高;
②一氧化碳是可燃性气体燃烧过程中放热;
③为了检测CO对空气的污染情况,常需用到氯化钯(PdCl2)溶液.将CO气体通入氯化钯(PdCl2)溶液中(水也参与反应),能产生黑色金属钯、CO2和一种酸.请写出该反应的化学反应方程式.
解答 解:(1)CO(g)燃烧热△H=-283kJ•mol-1,
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1,①
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453kJ•mol-1 ②
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1③
(①×2+③×2-②)得到CO(g)+2H2(g)=CH3OH(l)△H=-128.1KJ/mol,
故答案为:-128.1;
(2)CH3COOCu(NH3)2 (aq)+CO(g)?CH3COOCu(NH3)2•CO(aq)△H<0,反应是气体体积减小的放热反应,
a.适当升高温度平衡向吸热反应分析进行,则升温平衡逆向进行,可以重新生成醋酸亚铜氨,故a正确;
b.适当降低温度平衡向放热反应方向进行,不能重新生成醋酸亚铜氨,故b错误;
c.增大压强平衡向气体体积减小的方向进行,不能重新生成醋酸亚铜氨,故c错误;
d.减小压强平衡向气体体积增大的方向进行,可以重新生成醋酸亚铜氨,故d正确;
故答案为:ad;
(3)①CO吸附剂的开发大多数以铜(+1)为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO,图象方向可知时间越长CO回收率越高,为了保证载铜吸附剂对CO的吸附和提纯要求,应采取的措施是尽量在PSA-I中将CO2 脱除(保证PSA-I吸附CO2的时间),
故答案为:尽量在PSA-I中将CO2 脱除(保证PSA-I吸附CO2的时间);
②一氧化碳是可燃性气体燃烧过程中放热,可以作为燃料,
故答案为:作燃料;
③CO气体通入氯化钯(PdCl2)溶液中(水也参与反应),能产生黑色金属钯、CO2和一种酸,由质量守恒定律,该酸为盐酸,反应的俄化学方程式为:CO+PdCl2+H2O═Pd+CO2+2HCl,
故答案为:CO+PdCl2+H2O═Pd↓+2HCl+CO2.
点评 本题考查了反应能量变化、反应热的计算、化学平衡影响因素、图象的理解应用等知识点,掌握盖斯定律的应用、以及化学平衡的影响因素是解题关键,题目难度中等.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案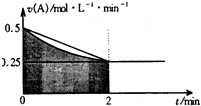 某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )
某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )| A. | 图中阴影部分的面积表示0-2min内A的物质的量浓度的减小值 | |
| B. | 反应开始的前2min,A的平均反应速率小于0.375mol•L-1•min-1 | |
| C. | 至2min时,A的物质的量减小值介于0.5mol至1mol之间 | |
| D. | 至2min时,c(B)介于1mol•L-1 至1.5mol•L-1 之间 |
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为吸热反应(填“吸热”或“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是BC(多选扣分).
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(3)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2和xmolH2,则:
①当x=5.0时,上述平衡向逆反应(填“正反应”、“逆反应”、“恰好平衡”)方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是0≤x<3.
(4)在850℃时,若设x=5.0mol和x=6.0mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a< b (填“>”、“<”或“=”).
| A. | 蒸发操作时,应使混合物中的水分大部分蒸干后,停止加热,利用余热蒸干 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 浓硫酸稀释时,应该将水缓缓加入盛浓硫酸的烧杯中,边加边搅拌 | |
| D. | 萃取分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| A. | Na+ 1s22s22p63s2 | B. | F 1s22s22p5 | ||
| C. | O2- 1s22s22p6 | D. | Ar 1s22s22p63s23p6 |
 ,Z的原子结构示意图为
,Z的原子结构示意图为 .
.