题目内容
 常温下有下列四种溶液:
常温下有下列四种溶液:| ① | ② | ③ | ④ | ||
| 溶液 | pH=4的NH4Cl | pH=4的盐酸 | 0.1mol?L-1的醋酸 | 0.1mol?L-1的NaOH | |
(1)用④的标准液滴定③宜选用
(2)将②③④三种溶液分别加水稀释10倍,pH变化最小的是
(3)都是0.1mol/L的①NH4Cl、②NH4HCO3、③CH3COONH4、④NH4HSO4的溶液中NH4+离子浓度大小顺序为
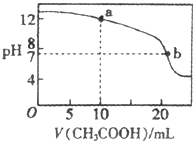
(4)取适量溶液③滴定20mL溶液④,滴定曲线如图所示,则a点时溶液中各离子浓度的大小关系为
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)滴定终点时溶液pH在所选取指示剂变色范围内,据此确定指示剂;酸或碱抑制水电离,含有弱离子的盐促进水电离,①②溶液中由水电离出的c(H+)分别为10-4mol/L、10-10mol/L;
(2)加水稀释促进弱电解质电离,强电解质在水溶液中完全电离;用pH试纸测定溶液pH的操作方法是:
将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照;
(3)氢离子抑制铵根离子水解、醋酸根离子和碳酸氢根离子促进铵根离子水解,醋酸根离子水解程度小于碳酸氢根离子,弱酸根离子水解程度越大,铵根离子水解程度越大;
(4)醋酸体积为10mL时,混合溶液中的溶质为等物质的量浓度的CH3COONa、NaOH,溶液呈碱性,溶液中部分CH3COO-水解,据此判断离子浓度大小;醋酸钠溶液呈碱性,要使混合溶液呈中性,则醋酸物质的量稍微大于NaOH.
(2)加水稀释促进弱电解质电离,强电解质在水溶液中完全电离;用pH试纸测定溶液pH的操作方法是:
将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照;
(3)氢离子抑制铵根离子水解、醋酸根离子和碳酸氢根离子促进铵根离子水解,醋酸根离子水解程度小于碳酸氢根离子,弱酸根离子水解程度越大,铵根离子水解程度越大;
(4)醋酸体积为10mL时,混合溶液中的溶质为等物质的量浓度的CH3COONa、NaOH,溶液呈碱性,溶液中部分CH3COO-水解,据此判断离子浓度大小;醋酸钠溶液呈碱性,要使混合溶液呈中性,则醋酸物质的量稍微大于NaOH.
解答:
解:(1)滴定终点时溶液pH在所选取指示剂变色范围内,醋酸钠溶液呈碱性,其溶液pH>7,酚酞的变色范围为5-8,故选酚酞;酸或碱抑制水电离,含有弱离子的盐促进水电离,①②溶液中由水电离出的c(H+)分别为10-4mol/L、10-10mol/L,所以;①②溶液中由水电离出的c(H+)之比为:10-4mol/L:10-10mol/L=106:1,故答案为:酚酞;106:1;
(2)加水稀释促进弱电解质电离,强电解质在水溶液中完全电离,所以pH变化最小的是醋酸,用pH试纸测定溶液pH的操作方法是:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照,
故答案为:③;将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照;
(3)H+抑制NH4+水解、CH3COO-和HCO3-促进NH4+水解,水解程度:CH3COO-<HCO3-,弱酸根离子水解程度越大,NH4+水解程度越大,所以铵根离子浓度大小顺序是④>①>③>②,故答案为:④>①>③>②;
(4)醋酸体积为10mL时,混合溶液中的溶质为等物质的量浓度的CH3COONa、NaOH,溶液呈碱性,溶液中部分CH3COO-水解,所以离子浓度大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+);醋酸钠溶液呈碱性,要使混合溶液呈中性,则醋酸物质的量稍微大于NaOH,所以V>20,
故答案为:c(Na+)>c(OH-)>c(CH3COO-)>c(H+);>.
(2)加水稀释促进弱电解质电离,强电解质在水溶液中完全电离,所以pH变化最小的是醋酸,用pH试纸测定溶液pH的操作方法是:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照,
故答案为:③;将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照;
(3)H+抑制NH4+水解、CH3COO-和HCO3-促进NH4+水解,水解程度:CH3COO-<HCO3-,弱酸根离子水解程度越大,NH4+水解程度越大,所以铵根离子浓度大小顺序是④>①>③>②,故答案为:④>①>③>②;
(4)醋酸体积为10mL时,混合溶液中的溶质为等物质的量浓度的CH3COONa、NaOH,溶液呈碱性,溶液中部分CH3COO-水解,所以离子浓度大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+);醋酸钠溶液呈碱性,要使混合溶液呈中性,则醋酸物质的量稍微大于NaOH,所以V>20,
故答案为:c(Na+)>c(OH-)>c(CH3COO-)>c(H+);>.
点评:本题考查弱电解质的电离、离子浓度大小比较等知识点,会根据离子性质确定离子浓度大小,注意(1)中水电离出氢离子浓度的计算方法,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 单质硼有无定形和晶体两种,参考下列数据.
单质硼有无定形和晶体两种,参考下列数据. 如图为原电池的示意图.请回答:
如图为原电池的示意图.请回答: