题目内容
肼(N2H4)和过氧化氢混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量.
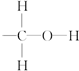
(1)写出过氧化氢的结构式: .
(2)写出该反应热化学方程式: .
(3)已知H2O(1)═H2O(g)△H=+44kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是 kJ.
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是:
.
(1)写出过氧化氢的结构式:
(2)写出该反应热化学方程式:
(3)已知H2O(1)═H2O(g)△H=+44kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是:
考点:反应热和焓变
专题:化学反应中的能量变化
分析:(1)过氧化氢分子式H2O2,每个氧原子形成两个共价键,依据结构写出物质的结构式;
(2)依据热化学方程式书写方法写出,标注物质聚集状态和反应焓变;
(3)依据热化学方程式和盖斯定律计算得到热化学方程式,得到反应的焓变;
(4)肼燃烧生成氮气和水.
(2)依据热化学方程式书写方法写出,标注物质聚集状态和反应焓变;
(3)依据热化学方程式和盖斯定律计算得到热化学方程式,得到反应的焓变;
(4)肼燃烧生成氮气和水.
解答:
解:(1)过氧化氢分子式H2O2,每个氧原子形成两个共价键,分子结构为:H-O-O-H,故答案为:H-O-O-H;
(2)0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量,32g肼燃烧放热641.625kJ;肼燃烧的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol;
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol;
(3)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol,
②H2O(l)═H2O(g)△H=+44kJ/mol;
依据盖斯定律,①-②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.625kJ/mol
则16g液态肼与足量液态过氧化氢反应生成氮气和液态水放热时408.8KJ,
故答案为:408.8;
(4)肼燃烧生成氮气和水,除释放大量热和快速产生大量气体外,生成的物质无污染,故答案为:生成N2和H2O,对环境无污染.
(2)0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量,32g肼燃烧放热641.625kJ;肼燃烧的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol;
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol;
(3)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol,
②H2O(l)═H2O(g)△H=+44kJ/mol;
依据盖斯定律,①-②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.625kJ/mol
则16g液态肼与足量液态过氧化氢反应生成氮气和液态水放热时408.8KJ,
故答案为:408.8;
(4)肼燃烧生成氮气和水,除释放大量热和快速产生大量气体外,生成的物质无污染,故答案为:生成N2和H2O,对环境无污染.
点评:本题考查了化学反应能量变化的计算应用,物质结构分析判断,盖斯定律的计算,热化学方程式书写方法,题目难度中等.

练习册系列答案
相关题目
下列离子方程式书写不正确的是( )
| A、FeCl2溶液中通入Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| B、澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-=CaCO3↓+H2O |
| C、FeS固体放人稀硝酸溶液中:FeS+2H+=Fe2++H2S↑ |
| D、AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3-↓ |
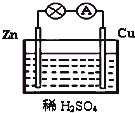 如图为原电池的示意图.请回答:
如图为原电池的示意图.请回答: