题目内容
2.按要求书写方程式:(1)向NaAlO2溶液中通入过量CO2的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(2)MnO2与浓盐酸制备氯气的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O
(3)工业上制备粗硅的化学方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
(4)硫酸铵溶液与氢氧化钡溶液共热的离子方程式:2NH4++SO42-+Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+BaSO4↓+2H2O.
分析 (1)二氧化碳过量,反应生成氢氧化铝沉淀和碳酸氢根离子;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(3)工业上用碳在高温下还原二氧化硅的方法获得粗硅;
(4)碳酸氢铵与氢氧化钡溶液加热反应生成硫酸钡沉淀、氨气和水,据此写出反应的离子方程式.
解答 解:(1)向NaAlO2溶液中通入过量CO2,反应生成碳酸氢钠和氢氧化铝沉淀,正确的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)MnO2与浓盐酸加热制备氯气,反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)工业上用碳在高温下还原二氧化硅的方法制备粗硅,反应的化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(4)硫酸铵溶液与氢氧化钡溶液共热生成氨气、硫酸钡沉淀和水,反应的离子方程式为:2NH4++SO42-+Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+BaSO4↓+2H2O,
故答案为:2NH4++SO42-+Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+BaSO4↓+2H2O.
点评 本题考查了离子方程式书写,题目难度中等,明确发生反应的实质为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

 走进文言文系列答案
走进文言文系列答案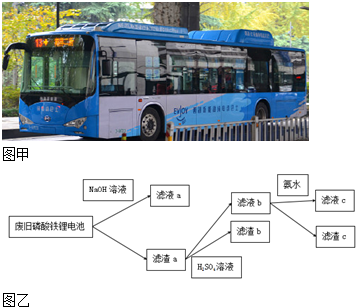
| A. | 向滤液a中加入适量H2SO4溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替 |
| A. | F2 | B. | Cl- | C. | NH3 | D. | NH2- |
 .其基态原子有7种能量不同的电子;
.其基态原子有7种能量不同的电子;
 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.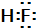 ;从HF、HCl混合气体中分离出HF的方法是冷凝.
;从HF、HCl混合气体中分离出HF的方法是冷凝.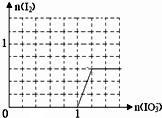 .
.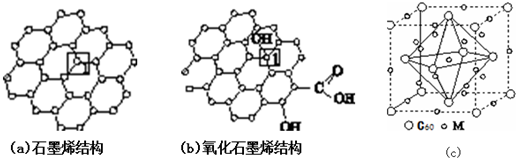
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60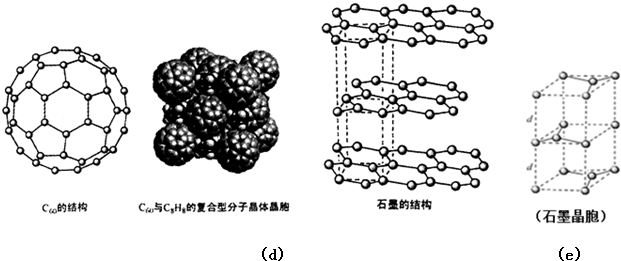
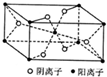 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是形成酸雨的主要气体之一;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.请回答下列问题:
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是形成酸雨的主要气体之一;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.请回答下列问题: