题目内容
11.石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示].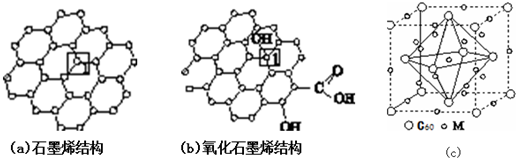
(1)图(a)中,1号C与相邻C形成σ键的个数为3.
(2)图(b)中,1号C的杂化方式是sp3,该C与相邻C形成的键角<(填“>”“<”或“=”) 图(a)中1号C与相邻C形成的键角.
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有O、H(填元素符号).
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图(c)所示,M原子位于晶胞的棱上与内部.该材料的化学式为M3C60.
(5)碳的一种同素异形体--C60,又名足球烯,是一种高度对称的球碳分子.立方烷(分子式:C8H8,结构是立方体:(
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60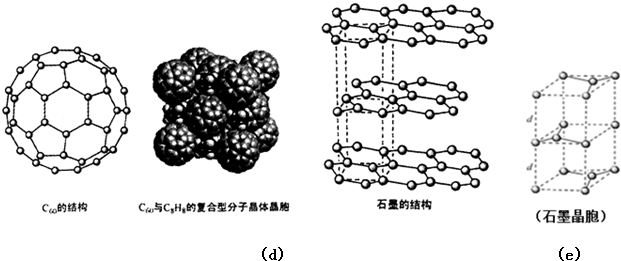
(6)碳的另一种同素异形体--石墨,其晶体结构如图(e)所示,虚线勾勒出的是其晶胞.则石墨晶胞含碳原子个数为4个.已知石墨的密度为ρg.cm-3,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为$\frac{\sqrt{3}}{16}$ρNAr2cm.
分析 (1)石墨烯中每个C原子和相邻3个碳原子形成3个σ键;
(2)氧化石墨烯中每个C原子形成4个σ键,价层电子对个数是4,根据价层电子对互斥理论判断C原子杂化方式;乙中每个碳原子和3个C、1个O原子形成四面体结构,甲中每个C原子和相邻3个碳原子形成平面结构;
(3)乙中含有羟基、羧基,O、H原子可以分别与水中H原子、O原子形成羟基;
(4)根据均摊法计算晶胞中M原子数目、C60个数,进而确定化学式;
(5)根据均摊法计算晶胞中C60数目,立方烷分子填充在原C60晶体的分子间空隙中,根据晶胞中C60数目确定立方烷数目,进而确定化学式;
(6)根据均摊法计算石墨晶胞中C原子数目,石墨的晶胞结构为 ,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为
,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为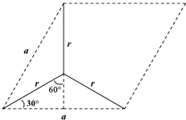 ,则$\frac{a}{2}$=r×sin60°,可得a=$\sqrt{3}$r,再计算底面面积,根据均摊法计算晶胞质量,结合ρ=$\frac{m}{{a}^{2}sin60°×2d}$计算
,则$\frac{a}{2}$=r×sin60°,可得a=$\sqrt{3}$r,再计算底面面积,根据均摊法计算晶胞质量,结合ρ=$\frac{m}{{a}^{2}sin60°×2d}$计算
解答 解:(1)由图可知,甲中1号C与相邻C形成3个C-C键,形成σ键的个数为3,故答案为:3;
(2)图乙中,1号C形成3个C-C及1个C-O键,C原子以sp3杂化,为四面体构型,而石墨烯中的C原子杂化方式均为sp2,为平面结构,则图乙中C与相邻C形成的键角<图甲中1号C与相邻C形成的键角,故答案为:sp3;<;
(3)乙中含有羟基、羧基,O、H原子可以分别与水中H原子、O原子形成羟基,故答案为:O、H;
(4)晶胞中,M原子个数=8+12×$\frac{1}{4}$+1=12、C60个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则C60与M原子个数之比=4:12=1:3,其化学式为 M3C60,故答案为:M3C60;
(5)晶胞中C60数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,立方烷分子填充在原C60晶体的分子间空隙中,晶胞中立方烷数目为4,则化学式为C8H8.C60,故答案为:C8H8.C60;
(6)由图可知石墨的晶胞结构为 ,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为
,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为 ,则$\frac{a}{2}$=r×sin60°,可得a=$\sqrt{3}$r,则底面面积为($\sqrt{3}$r)2×Sin60°,晶胞中C原子数目为1+2×$\frac{1}{2}$+8×$\frac{1}{8}$+4×$\frac{1}{4}$=4,晶胞质量为$\frac{4×12}{{N}_{A}}$g,则:
,则$\frac{a}{2}$=r×sin60°,可得a=$\sqrt{3}$r,则底面面积为($\sqrt{3}$r)2×Sin60°,晶胞中C原子数目为1+2×$\frac{1}{2}$+8×$\frac{1}{8}$+4×$\frac{1}{4}$=4,晶胞质量为$\frac{4×12}{{N}_{A}}$g,则:
ρg.cm-3=$\frac{4×12}{{N}_{A}}$g÷[($\sqrt{3}$r)2×Sin60°×2d]cm3,整理可得d=$\frac{\sqrt{3}}{16}$ρNAr2,
故答案为:4;$\frac{\sqrt{3}}{16}$ρNAr2.
点评 本题是对物质结构与性质的考查,涉及核化学键、氢键、杂化方式判断、晶胞计算等,(6)中计算为易错点、难点,基本属于纯数学计算,需要学生具备一定的数学计算能力,难度较大.

| A. | 按熔点由低到高排列I2、CO2、Hg、KCl、SiO2 | |
| B. | 在石英晶体中,每个硅原子和相邻的两个氧原子以共价键结合 | |
| C. | 有机物分子中碳原子成键方式和排列方式有多种以及同分异构现象的存在都是有机物种类繁多的原因 | |
| D. | 因为石墨是金刚石的同素异形体,所以二者空间结构相似,化学性质相似 |
| A. | 新戊烷 C(CH3)4 | B. | 3-乙基-1-丁烯 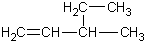 | ||
| C. | 2-甲基-2,4-己二烯 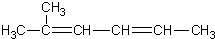 | D. | 2,2,3-三甲基戊烷 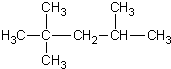 |
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(2 p) | C. | E(4f)>E(3d)>E(4s) | D. | E(5s)>E(4s)>E(4f) |
 某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | a电极的反应为:3CO2+18H+-18e-═C3H8O+5H2O | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | 该装置工作时H+从b极区向a极区迁移 |
| A. | 常温常压下,0.1molC3H8所含有的共价键数目为1.1 NA | |
| B. | 1mol苯分子中,含有碳碳双键的数目为3 NA | |
| C. | 常温常压下,15g甲基(-CH3)所含的电子数为10NA | |
| D. | 现有乙烯、丙烯的混合气体共14 g,其原子数为3NA |
| A. | 1mol O2(g)的能量一定高于2mol SO2(g)的能量 | |
| B. | 2mol SO2(g)和1mol O2(g)的总能量一定高于2mol SO3(g)的总能量 | |
| C. | 2mol SO2(g)的能量一定高于2mol SO3(g)的能量 | |
| D. | 因该反应为放热反应,故不必加热就可发生 |
 .
.