题目内容
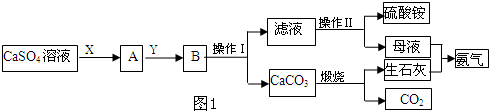
某化学小组在实验中利用CaSO4、NH3、CO2制备(NH4)2SO4,其工艺流程如图1.
回答下列问题:
(1)操作Ⅰ的名称为 ;操作Ⅱ一系列操作包括蒸发浓缩、 、过滤.
(2)实验室中煅烧碳酸钙时,盛放碳酸钙所用的仪器是 (填名称).
(3)X物质为 (填化学式,下同),Y物质为 ,可循环利用的物质的有 .
(4)要测定所制得的硫酸铵纯度,取10.0g样品,完全溶于水,向溶液中滴加过量的氯化钡溶液,过滤、洗涤、干燥后称量固体的质量为16.31g.为避免引起误差,检验氯化钡溶液是否过量最好的试剂是 ,所制得硫酸铵的纯度为 .
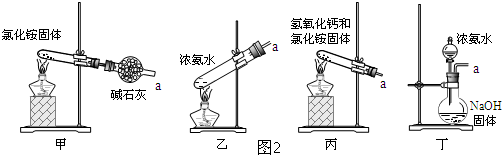
(5)图2中装置不能用于实验室制氨气的是 (填序号).
选择氨气的制取装置后,再用图3装置收集干燥的氨气,并制取硫酸铵溶液,连接的顺序(用接口序号字母表示)是:a接 , 接 , 接 , 接 .
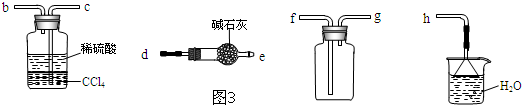
上述装置中CCl4的作用是 .

回答下列问题:
(1)操作Ⅰ的名称为
(2)实验室中煅烧碳酸钙时,盛放碳酸钙所用的仪器是
(3)X物质为
(4)要测定所制得的硫酸铵纯度,取10.0g样品,完全溶于水,向溶液中滴加过量的氯化钡溶液,过滤、洗涤、干燥后称量固体的质量为16.31g.为避免引起误差,检验氯化钡溶液是否过量最好的试剂是
(5)图2中装置不能用于实验室制氨气的是

选择氨气的制取装置后,再用图3装置收集干燥的氨气,并制取硫酸铵溶液,连接的顺序(用接口序号字母表示)是:a接

上述装置中CCl4的作用是
考点:制备实验方案的设计,铵盐,氨的制取和性质
专题:氮族元素
分析:硫酸钙悬浊液通入足量的氨气,使溶液成碱性,再通适量的二氧化碳,与溶液中的氨水、硫酸钙悬浊液反应生成碳酸钙沉淀和硫酸铵溶液,经过过滤分离得到碳酸钙沉淀再煅烧生成生石灰,而旅游硫酸铵经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥得到硫酸铵晶体;
(1)常见物质的分离提纯方法;
(2)固体物质加热,把固体放在坩埚中;
(3)中性条件下CO2的溶解度很小,但是氨气易溶于水,得到的碱性溶液易和二氧化碳反应,能把CaSO4完全转化为CaCO3;
(4)测定所制得的硫酸铵纯度,使硫酸根离子完全沉淀,求得硫酸铵的物质的量、质量;
(5)氨气的实验室制备、净化、尾气吸收.
(1)常见物质的分离提纯方法;
(2)固体物质加热,把固体放在坩埚中;
(3)中性条件下CO2的溶解度很小,但是氨气易溶于水,得到的碱性溶液易和二氧化碳反应,能把CaSO4完全转化为CaCO3;
(4)测定所制得的硫酸铵纯度,使硫酸根离子完全沉淀,求得硫酸铵的物质的量、质量;
(5)氨气的实验室制备、净化、尾气吸收.
解答:
解:硫酸钙悬浊液通入足量的氨气,使溶液成碱性,再通适量的二氧化碳,与溶液中的氨水、硫酸钙悬浊液反应生成碳酸钙沉淀和硫酸铵溶液,经过过滤分离得到碳酸钙沉淀再煅烧生成生石灰,而旅游硫酸铵经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥得到硫酸铵晶体;
(1)由分析知:B为碳酸钙沉淀和硫酸铵溶液,分离二者的实验操作应为:过滤,滤液硫酸铵溶液,使硫酸铵在溶液中析出的方法为:先加热制成饱和溶液
(蒸发浓缩)再降温冷却,结晶析出(冷却结晶),过滤;
故答案为:过滤;冷却结晶;
(2)碳酸钙为固体,高温加热或煅烧固体,应把固体放在坩埚中,故盛放碳酸钙所用的仪器是坩埚;
故答案为:坩埚;
(3)中性条件下CO2的溶解度很小,但是氨气易溶于水,得到的碱性溶液易和二氧化碳反应,能把CaSO4完全转化为CaCO3,往CaSO4悬浊液中加入NH3后,发生反应如下:CaSO4+2NH3+2H2O Ca(OH)2+(NH4)2SO4,向其中加入CO2可以生成CaCO3,平衡向正方向移动,有利于(NH4)2SO4的生成,则X为NH3,Y为CO2;根据反应流程得知:工艺流程中生成NH3和CO2,也需要使用NH3和CO2,可循环利用的物质的有NH3,CO2;
Ca(OH)2+(NH4)2SO4,向其中加入CO2可以生成CaCO3,平衡向正方向移动,有利于(NH4)2SO4的生成,则X为NH3,Y为CO2;根据反应流程得知:工艺流程中生成NH3和CO2,也需要使用NH3和CO2,可循环利用的物质的有NH3,CO2;
故答案为:NH3;CO2; NH3,CO2;
(4)要测定所制得的硫酸铵纯度,取10.0g样品,完全溶于水,向溶液中滴加过量的氯化钡溶液,目的是使硫酸根离子完全沉淀,静置向上层清液再滴加氯化钡就不会有沉淀生成,可以检验氯化钡是否已过量;
向溶液中滴加过量的氯化钡溶液,过滤、洗涤、干燥后的固体为硫酸钡,质量为16.31g,n(BaSO4)=
=
=0.07mol,n((NH4)2SO4)=n(SO42+)=n(BaSO4)=0.07mol,m((NH4)2SO4)=n?M=0.07mol×132g/mol=9.24g,硫酸铵的纯度=
×100%=92.4%;
故答案为:氯化钡溶液;92.4%;
(5)甲:氯化铵受热分解成氨气和氯化氢,但氨气和氯化氢一冷却马上又可以化合成氯化铵,这个方案很难制氨气;
乙:氨水中存在平衡关系:NH3+H2O═NH3?H2O═NH4++OH-,加热浓氨水,氨气溶解度降低,从溶液中逸出,平衡向逆反应方向移动,可以制取氨气;
丙:熟石灰和氯化铵混合后加热可以制取氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,可以制取氨气;
丁:利用CaO与H2O剧烈反应,生成Ca(OH)2,放出大量热,促进NH3?H2O的分解及NH3的挥发逸出,又由于Ca(OH)2是强碱,也促进NH3?H2O的分解及NH3的挥发逸出,反应的化学方程式为:NH3?H2O+CaO═NH3↑+Ca(OH)2,可以制取氨气;故选甲;
选择氨气的制取装置后,再用图3装置收集干燥的氨气,并制取硫酸铵溶液,顺序为:制气装置、干燥装置、集气装置、吸收装置、尾气处理装置;连接的顺序(用接口序号字母表示)是:de,gf,cb,h;
上述装置中,水的密度比四氯化碳小,浮在四氯化碳的上面,四氯化碳不能和氨气反应,也不溶解氨气,该装置既能够吸收易溶性气体,又能够防止倒吸;
故答案为:甲;d;e;g;f;c;b;h;防倒吸.
(1)由分析知:B为碳酸钙沉淀和硫酸铵溶液,分离二者的实验操作应为:过滤,滤液硫酸铵溶液,使硫酸铵在溶液中析出的方法为:先加热制成饱和溶液
(蒸发浓缩)再降温冷却,结晶析出(冷却结晶),过滤;
故答案为:过滤;冷却结晶;
(2)碳酸钙为固体,高温加热或煅烧固体,应把固体放在坩埚中,故盛放碳酸钙所用的仪器是坩埚;
故答案为:坩埚;
(3)中性条件下CO2的溶解度很小,但是氨气易溶于水,得到的碱性溶液易和二氧化碳反应,能把CaSO4完全转化为CaCO3,往CaSO4悬浊液中加入NH3后,发生反应如下:CaSO4+2NH3+2H2O
 Ca(OH)2+(NH4)2SO4,向其中加入CO2可以生成CaCO3,平衡向正方向移动,有利于(NH4)2SO4的生成,则X为NH3,Y为CO2;根据反应流程得知:工艺流程中生成NH3和CO2,也需要使用NH3和CO2,可循环利用的物质的有NH3,CO2;
Ca(OH)2+(NH4)2SO4,向其中加入CO2可以生成CaCO3,平衡向正方向移动,有利于(NH4)2SO4的生成,则X为NH3,Y为CO2;根据反应流程得知:工艺流程中生成NH3和CO2,也需要使用NH3和CO2,可循环利用的物质的有NH3,CO2;故答案为:NH3;CO2; NH3,CO2;
(4)要测定所制得的硫酸铵纯度,取10.0g样品,完全溶于水,向溶液中滴加过量的氯化钡溶液,目的是使硫酸根离子完全沉淀,静置向上层清液再滴加氯化钡就不会有沉淀生成,可以检验氯化钡是否已过量;
向溶液中滴加过量的氯化钡溶液,过滤、洗涤、干燥后的固体为硫酸钡,质量为16.31g,n(BaSO4)=
| m |
| M |
| 16.31g |
| 233g/mol |
| 9.24g |
| 10.0g |
故答案为:氯化钡溶液;92.4%;
(5)甲:氯化铵受热分解成氨气和氯化氢,但氨气和氯化氢一冷却马上又可以化合成氯化铵,这个方案很难制氨气;
乙:氨水中存在平衡关系:NH3+H2O═NH3?H2O═NH4++OH-,加热浓氨水,氨气溶解度降低,从溶液中逸出,平衡向逆反应方向移动,可以制取氨气;
丙:熟石灰和氯化铵混合后加热可以制取氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2
| ||
丁:利用CaO与H2O剧烈反应,生成Ca(OH)2,放出大量热,促进NH3?H2O的分解及NH3的挥发逸出,又由于Ca(OH)2是强碱,也促进NH3?H2O的分解及NH3的挥发逸出,反应的化学方程式为:NH3?H2O+CaO═NH3↑+Ca(OH)2,可以制取氨气;故选甲;
选择氨气的制取装置后,再用图3装置收集干燥的氨气,并制取硫酸铵溶液,顺序为:制气装置、干燥装置、集气装置、吸收装置、尾气处理装置;连接的顺序(用接口序号字母表示)是:de,gf,cb,h;
上述装置中,水的密度比四氯化碳小,浮在四氯化碳的上面,四氯化碳不能和氨气反应,也不溶解氨气,该装置既能够吸收易溶性气体,又能够防止倒吸;
故答案为:甲;d;e;g;f;c;b;h;防倒吸.
点评:本题为工艺流程题,涉及原料、产品的判断、方程式的书写、检验、气体的制备等.做题时要充分利用所给的信息,结合自己已学过的知识,进行有依据性的推测、计算,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
关于氧化剂的叙述正确的是( )
| A、分子中不一定含有氧元素 |
| B、分子中一定含有氧元素 |
| C、在反应中有元素化合价升高 |
| D、在反应中有元素化合价降低 |
下列离子方程式或化学反应方程式与所述事实相符且正确的是( )
| A、将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=SO32-+2HClO |
| B、将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ/mol |
| C、向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2 |
| D、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
下列叙述:①同温同压下相同体积的物质,其物质的量一定相等②任何条件下、等物质的量的氨气和一氧化碳所含的分子数一定相等 ③1L一氧化碳气体一定比1L氧气的质量小④相同条件下的一氧化碳气体和氮气,其密度一定相等.其中正确的是( )
| A、①②③④ | B、①②④ |
| C、①④ | D、其它组合 |
下列反应所产生的气体体积在标准状况下为22.4L的是( )
| A、将2mol金属Cu与含2molH2SO4的浓硫酸共热 |
| B、将1 mol MnO2固体与含4molHCl的浓盐酸共热 |
| C、常温下,将32.2g金属钠和5.4g金属铝同时投入到足量水中 |
| D、常温下,将10.8g的Al和22.4g的Fe投入到300g 98%的硫酸中 |
 某同学设计了如下方案,来测定过氧化钠的样品的纯度(杂质不参加反应,条件为标准状况).
某同学设计了如下方案,来测定过氧化钠的样品的纯度(杂质不参加反应,条件为标准状况).
 )
)