题目内容
18.除去下列物质中的杂质,采用的试剂和除杂方法中有错误的是( )| 序号 | 待除杂质(括号中为杂质) | 试剂 | 除杂方法 |
| A | 苯甲酸固体(NaCl固体) | 蒸馏水 | 重结晶 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 酒精(水) | 生石灰 | 蒸馏 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二者溶解度受温度影响不同;
B.乙烯被高锰酸钾氧化生成二氧化碳;
C.CaO与水反应后,增大与乙醇的沸点差异;
D.苯酚与溴水反应,溴、三溴苯酚均易溶于苯.
解答 解:A.二者溶解度受温度影响不同,则溶于水后重结晶可分离,故A正确;
B.乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质,不能除杂,应选溴水、洗气,故B错误;
C.CaO与水反应后,增大与乙醇的沸点差异,然后蒸馏可分离,故C正确;
D.苯酚与溴水反应,溴、三溴苯酚均易溶于苯,引入新杂质,应选NaOH、分液,故D错误;
故选BD.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
8.若将海水淡化作饮用水使用,下列方法在原理上完全不可行的是( )
| A. | 加明矾使海水中的盐分沉淀而淡化 | |
| B. | 利用太阳能使海水蒸馏淡化 | |
| C. | 将海水缓慢凝固以获取淡化的饮用水 | |
| D. | 将海水通过离子交换树脂,以除去所含离子 |
9.下列离子方程式正确的是( )
| A. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| C. | SO2通入新制氯水中:SO2+Cl2+2H2O═SO42-+2Cl-+4H+ | |
| D. | 向KAl(SO4)2溶液中滴入Ba(OH)2恰好使Al3+完全沉淀:Ba2++3OH-+Al3++SO42-═BaSO4↓+Al(OH)3↓ |
6.下列关于实验的叙述,正确的是( )
| A. | 滴定管的润洗是向滴定管中加入少量要盛装的溶液,边旋转边倾斜使溶液润湿全部内壁后从上口倒出 | |
| B. | 中和热的测定需要使用两个量筒分别量取酸碱溶液体积,使用两个温度计分别测定开始和终点的溶液温度 | |
| C. | 用密度为1.84g/cm3的浓硫酸配制100mL的2mol/L的稀硫酸,需要计算并称量浓硫酸的质量 | |
| D. | 用重结晶法提纯粗苯甲酸时,溶解度较小的杂质趁热过滤时留在了滤纸上,溶解度较大的杂质冷却结晶时留在了母液里 |
13.下列关于醇和酚的说法中,正确的是( )
| A. | 在水中乙醇和苯酚都不能电离 | |
| B. | 分子内有苯环和羟基的化合物一定是酚 | |
| C. | 苯甲醇与2-甲基苯酚互为同分异构体 | |
| D. | 酚和醇具有相同的官能团,因而具有相同的化学性质 |
3.有机物分子中的原子(团)之间会相互影响,导致相同的原子(团)表现出不同的性质.下列现象不能说明上述观点的是( )
| A. | 苯酚与溴水可以直接反应,而苯与液溴反应则需要铁作催化剂 | |
| B. | 乙烯能与溴水发生加成反应,而乙烷不能与溴水发生加成反应 | |
| C. | 甲苯能使酸性KMnO4溶液褪色,而甲基环己烷不能使酸性KMnO4溶液褪色 | |
| D. | 苯酚可以与NaOH反应,而乙醇不能与NaOH反应 |
10.在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g)
其化学平衡常数K与温度t的关系如表:
(1)该反应的化学平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是ad.
a、混合气体中c(CO)不变 b、容器中压强不变
c、c(CO2)=c(CO) d、v正(H2)=v逆(H2O)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O)试判断此时的温度为950℃.
(5)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度c(CO2)为2mol•L-1,c(H2)为1.5mol•L-1,c(CO)为1mol•L-1,c(H2O)为3mol•L-1则下一时刻,反应将逆向(填“正向”或“逆向”)进行.
CO2(g)+H2(g)?CO(g)+H2O(g)
其化学平衡常数K与温度t的关系如表:
| t℃ | 700 | 800 | 950 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是ad.
a、混合气体中c(CO)不变 b、容器中压强不变
c、c(CO2)=c(CO) d、v正(H2)=v逆(H2O)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O)试判断此时的温度为950℃.
(5)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度c(CO2)为2mol•L-1,c(H2)为1.5mol•L-1,c(CO)为1mol•L-1,c(H2O)为3mol•L-1则下一时刻,反应将逆向(填“正向”或“逆向”)进行.
7.下列有关说法正确的是( )
| A. | CO2和SiO2化学键类型相同,晶体类型不同 | |
| B. | 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 | |
| C. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 | |
| D. | 氯化钠熔化时离子键未被破坏 |
8.下列化学用语的书写,正确的是( )
| A. | 氯气的分子式 Cl | B. | 钠原子的结构示意图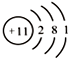 | ||
| C. | N2的电子式:N:::N: | D. | NaCl的电子式 Na+:Cl: |