题目内容
20.下列离子中不含配位键的是( )| A. | Ag(NH3)2+ | B. | NH4+ | C. | OH- | D. | O22- |
分析 中心原子或离子含有空轨道,配体含有孤对电子,相互之间可以形成配位键.
解答 解:A.Ag(NH3)2+中Ag+含有空轨道,NH3含有孤对电子,Ag+含与NH3之间形成配位键,故A不选;
B.H+含空轨道,NH3含有孤对电子,二者通过配位键形成NH4+,故B不选;
C.氢氧根离子中氧原子含有孤电子对,但氢原子不含空轨道,不能形成配位键,故C选;
D.O22-中O原子没有空轨道,不存在配位键,故D选,
故选:CD.
点评 本题考查了配合物的成键情况,明确配位键的形成条件是解本题关键,会表示配合物中配位键,难度不大.

练习册系列答案
相关题目
10.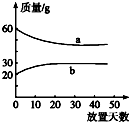 浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如图,分析a、b曲线变化的原因是( )
浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如图,分析a、b曲线变化的原因是( )
 浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如图,分析a、b曲线变化的原因是( )
浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如图,分析a、b曲线变化的原因是( )| A. | a升华、b冷凝 | B. | a冷凝、b吸水 | C. | a挥发、b潮解 | D. | a挥发、b吸水 |
11.下列有机物的系统命名正确的有( )
| A. | 2,3-二甲基-3,3-二乙基戊烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. | 2,2-二甲基-2-丁醇 | D. | 2,3-二甲基-1-丁醇 |
15. 如图为铁的吸氧腐蚀实验装置,下列说法中错误的是( )
如图为铁的吸氧腐蚀实验装置,下列说法中错误的是( )
 如图为铁的吸氧腐蚀实验装置,下列说法中错误的是( )
如图为铁的吸氧腐蚀实验装置,下列说法中错误的是( )| A. | 右玻璃管内液面高于左玻璃管内液面 | |
| B. | 溶液中的Cl-向铁钉方向移动 | |
| C. | 石墨棒做正极,电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 向插人铁钉的玻璃管内滴人Na0H溶液,可观察到铁钉附近的溶液中有沉淀生成 |
5.下列各组纯净物中,其分子内部都存在极性键且均为共价化合物的是( )
| A. | H2、NH3、SO3 | B. | CO2、CH4、C2H5OH | C. | NO、CaO、Ne | D. | P4、CS2、Na2CO3 |
19.浓盐酸与次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是①CO2;②HCl;③H2O(气);④O2( )
| A. | ①②③④ | B. | ②③④ | C. | ②③ | D. | ①④ |
20.用1L0.5mol/L氢氧化钠溶液吸收0.4摩尔二氧化碳,所得溶液中的碳酸根离子和碳酸氢根离子的物质的量浓度之比约是( )
| A. | 3:1 | B. | 1:2 | C. | 2:3 | D. | 1:3 |