题目内容
2.取一定量CuO粉末与0.5L稀硫酸充分反应后,将一根50g铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24g,并收集到224mL H2(标准状况).计算:(1)与稀硫酸反应的铁的物质的量
(2)此CuO粉末的质量
(3)原稀硫酸的物质的量浓度.
分析 由信息可知,加入铁反应还生成氢气,则一定量的CuO粉末与0.5L稀硫酸充分反应,发生CuO+H2SO4═CuSO4+H2O,且硫酸剩余,然后加Fe,发生Fe+CuSO4═FeSO4+Cu、Fe+H2SO4═FeSO4+H2↑,然后结合气体的体积及质量差计算.
解答 解:(1)氧化铜能与硫酸反应生成硫酸铜和水,生成的硫酸铜能与铁反应生成硫酸亚铁和铜,生成的铜附着在铁的表面,铁能与硫酸反应生成氢气,设生成0.02g氢气需要铁的质量为x则有
Fe+H2SO4═FeSO4+H2↑
56 1mol 2
x 0.01mol 0.02g
$\frac{56}{x}=\frac{2}{0.02}$,
x=0.56g,其物质的量为$\frac{0.56g}{56g/mol}$=0.01mol,
答:与硫酸反应的铁的物质的量为0.01mol;
(2)与硫酸铜反应的铁的质量为50g-0.56g=49.44g,反应后铁棒的质量为50.24g,说明铁与硫酸铜反应时增重的质量为50.24g-49.44g=0.8g,设硫酸铜的质量为y,根据反应的化学方程式则有
Fe+CuSO4═FeSO4+Cu△m
56 160 64 8
y 0.8g
$\frac{160}{y}=\frac{8}{0.8g}$,
解得y=16g,
设氧化铜的质量为z.则有
CuO+H2SO4═CuSO4+H2O
80 160
z 16g
$\frac{80}{z}=\frac{160}{16g}$,解得z=8g,
答:此CuO粉末的质量为8g;
(3)原稀硫酸的物质的量浓度为:$\frac{0.01+\frac{16g}{160g}}{0.5L}$=0.22mol/L,答:原稀硫酸的物质的量浓度为0.22mol/L.
点评 本题考查了金属活动性顺序的应用以及根据化学方程式的计算,注意发生的化学反应及反应中过量的分析是解答本题的关键,差量法计算为解答的难点.

 阅读快车系列答案
阅读快车系列答案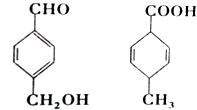
| A. | 互为同分异构体 | |
| B. | 均能使酸性高锰酸钾溶液褪色 | |
| C. | 均可以发生加成和取代反应 | |
| D. | 既能用红外光谱区分,也可以用核磁共振氢谱区分 |
| A. | NH3•H2O+HCl═NH4Cl+H2O | B. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | ||
| C. | Al(OH)3+3HCl═AlCl3+3H2O | D. | KOH+HNO3═KNO3+H2O |
| A. | Ag(NH3)2+ | B. | NH4+ | C. | OH- | D. | O22- |
 ,这种炔烃有( )
,这种炔烃有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |

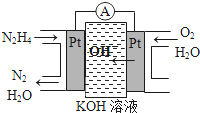
| A. | 装置一中铁片的生锈速度比装置二要慢 | |
| B. | 装置一中Ⅰ电极上有气泡冒出 | |
| C. | 一段时间后,两个装置中II和IV电极附近出现红色 | |
| D. | 装置二中加入少量KSCN溶液,溶液变为血红色 |
| A. | 一定增大 | B. | 一定减小 | ||
| C. | 一定不变 | D. | 可能减小也可能不变 |
 某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应: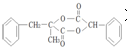 )是一种新型香料的主要成分之一.I的合成路线如下(部分产物和部分反应条件略去):
)是一种新型香料的主要成分之一.I的合成路线如下(部分产物和部分反应条件略去):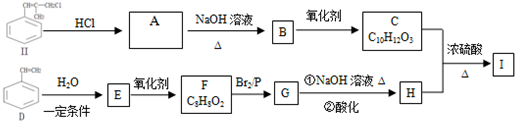

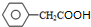 .
. .
. (写结构简式).
(写结构简式).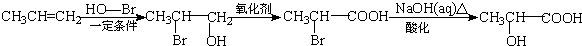 .
.