题目内容
3.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气.已知:N2(g)+2O2(g)=N2O4(g);△H=+a kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-b kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-(b+a) kJ/mol | |
| B. | N2H4(g)+$\frac{1}{2}$N2O4(g)=$\frac{3}{2}$N2(g)+2H2O(g);△H=-(2b+a)kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-(a-2b) kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-(b-a) kJ/mol |
分析 已知①N2(g)+2O2(g)═N2O4(g),△H=+aJ/mol;②N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-bkJ/mol;利用盖斯定律将②×2-①可得2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g),并以此计算反应热.
解答 解:已知①N2(g)+2O2(g)═N2O4(g),△H=+akJ/mol,
②N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-bJ/mol,
利用盖斯定律将②×2-①可得2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g),△H=(-bmol)×2-(+akJ/mol)=-(2b+a)KJ/mol,
故选B.
点评 本题考查反应热的计算、盖斯定律的应用,题目难度中等,明确盖斯定律的内容及其应用方法为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
14.25℃的某溶液中由水电离出的[H+]=1.0×10-13 moI•L-1,下列对该溶液的叙述中不正确的是( )
| A. | 用pH计测定酸碱度,结论为pH为1或13 | |
| B. | 加入NaHCO3粉末,可能生成CO2 | |
| C. | 加人铝片,一定能生成H2 | |
| D. | 滴人NaOH溶液,-lg[OH-]一定减小 |
11.下列叙述中,正确的是( )
| A. | 自然界中存在大量单质硅 | |
| B. | 石英、水晶、硅石的主要成分都是二氧化硅 | |
| C. | 常温下硅性质活泼,能与氯气、强酸反应 | |
| D. | 自然界中的硅是以二氧化硅或硅酸盐的形式存在 |
18.相同质量的两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出氢气的体积之比为( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 1:6 |
8.下列各组离子在指定的溶液中能太量共存的是( )
| A. | 在硝酸亚铁溶液中:Al3+、H+、SO42-、Cl- | |
| B. | 在透明溶液中:Fe3+、Mg2+、NO3-、HCO3- | |
| C. | 在含SO2的溶液中:Fe3+、Na+、Cl-、SO42- | |
| D. | pH=0的溶液中:NH4+、Fe2+、SO42-、Br- |
12.不能使橙色溴水变为无色的是( )
| A. | NaOH溶液 | B. | 用CCl4多次萃取 | C. | 锌粉 | D. | KI溶液 |


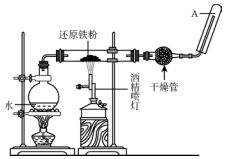 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.