题目内容
13.实验室制取、净化并收集氯气涉及以下几个主要阶段:
(1)写出实验室制取Cl2的离子方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,NA表示阿伏加德罗常数,若有4mol的HCl参加反应,则转移的电子总数为2NA;
(2)现有以下3种试剂:A.饱和食盐水 B.浓硫酸 C.NaOH溶液
请在以上试剂中选择并回答填空:
X溶液应选用A (填写序号);Y试剂的作用除去氯气中混有的水蒸气(或干燥氯气).
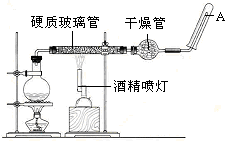
(3)某化学兴趣小组为了探究Cl2的相关性质,设计了如图1的实验.
通入Cl2后,从观察集气瓶A、B中的现象可得出的结论是Cl2+H2O=HClO+HCl次氯酸有漂白性,写出化学反应方程式,并用简要文字解释).
(4)某兴趣小组的同学为探究和比较SO2和氯水的漂白性,设计了如如2的实验装置.

①实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:分液漏斗的玻璃塞没有取下来;
②反应开始一段时间后,观察到B、D两试管中的品红溶液都出现褪色的现象,但两者褪色原理不同,如何区别,请你帮助设计实验,你的操作是停止通气后,再给B、D两个试管分别加热.
分析 (1)实验室用加热二氧化锰与浓盐酸的方法制取氯气,二者反应生成氯化锰、氯气和水;氯化氢在反应中只有1半被氧化,做还原剂,据此判断转移电子数目;
(2)浓盐酸易挥发,所以制取的氯气中含有氯化氢、水蒸气,应依次通过饱和食盐水、浓硫酸除去;
(3)氯气不具有漂白性,具有漂白性的是氯气与水反应生成的次氯酸,据此解答;
(4)①使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出;
②依据二氧化硫漂白性具有不稳定性,受热易恢复颜色,次氯酸漂白具有稳定性,受热不恢复颜色解答.
解答 解:(1)实验室用加热二氧化锰与浓盐酸的方法制取氯气,二者反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,依据方程式可知,参加反应氯化氢4mol,自由2mol氯化氢中-1价化合价升高为氯气中的0价,转移电子数目为:2NA;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;2NA;
(2)浓盐酸易挥发,所以制取的氯气中含有氯化氢、水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以可通过盛有饱和食盐水的洗气瓶除去氯化氢,再通过盛有浓硫酸的洗气瓶除去水蒸气;
故答案为:A;除去氯气中混有的水蒸气(或干燥氯气);
(3)通入Cl2后,从观察集气瓶A、B中的现象A瓶不褪色,B瓶布条褪色,可得出的结论是:氯气不具有漂白性,氯气与水反应生成次氯酸,次氯酸具有漂白性,化学方程式:Cl2+H2O=HClO+HCl;
故答案为:Cl2+H2O=HClO+HCl 次氯酸有漂白性;
(4)①使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出,打开分液漏斗,发现其中的液体不能流下,可能的原因是分液漏斗瓶塞未打开;
故答案为:分液漏斗的玻璃塞没有取下来;
②二氧化硫漂白性具有不稳定性,受热易恢复颜色,次氯酸漂白具有稳定性,受热不恢复颜色,所以为区别二者可以进行如下操作:停止通气后,再给B、D两个试管分别加热;
故答案为:停止通气后,再给B、D两个试管分别加热.
点评 本题考查了二氧化硫与氯气的制取以及二氧化硫漂白与次氯酸漂白的区别,明确二者制备原理及漂白原理是解题关键,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 植物油和自来水(蒸馏) | B. | 水溶液中的食盐和碘(分液) | ||
| C. | Fe(OH)3胶体中的HCl(过滤) | D. | SiO2和CaCl2(溶解、过滤、蒸发) |
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3、CO32-、SO42-、SiO32- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 在Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
(1)实验I能确定一定不存在的阳离子是Ag+、Mg2+、Ba2+.
(2)实验I中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓.
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
(4)判断K+是否存在存在,(填“是”或“否”)若存在求其最小浓度,若不存在说明理由其浓度至少为0.8mol/L.
| A. | 在18g${\;}_{\;}^{18}$O2中含有NA个氧分子 | |
| B. | 标准状况下,22.4L空气含有NA个单质分子 | |
| C. | 1 molCI2参加反应转移电子数可能为1NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol•L-1 |
| 序号 | 甲 | 乙 | 丙 |
| ① | HCl | CO2 | 少量NaAl(OH)4 |
| ② | CO2 | NH3 | 少量CaCl2 |
| ③ | N2 | NH3 | 少量AgNO3 |
| ④ | CO2 | SO2 | 过量Ba(NO3)2 |
| ⑤ | HCl | CO2 | 过量石灰水 |
| A. | ②③④ | B. | ②④ | C. | ①③ | D. | ④⑤ |
已知:N2(g)+2O2(g)=N2O4(g);△H=+a kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-b kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-(b+a) kJ/mol | |
| B. | N2H4(g)+$\frac{1}{2}$N2O4(g)=$\frac{3}{2}$N2(g)+2H2O(g);△H=-(2b+a)kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-(a-2b) kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-(b-a) kJ/mol |

 ;F、G、M三种元素最高价氧化物对应的水化物碱性最强的是Ca(OH)2(填化学式).
;F、G、M三种元素最高价氧化物对应的水化物碱性最强的是Ca(OH)2(填化学式).