题目内容
1.利用石墨电极电解1mol/L氯化钠溶液,并收集阳极气体检验其成分.已知:O2能使酸性的淀粉KI溶液变蓝,不能使中性的淀粉KI溶液变蓝.实验:
①将气体通入中性的淀粉KI溶液中,溶液变蓝.
②用足量NaOH溶液充分洗气,气体体积减少,将剩余气体通入中性的淀粉KI溶液中,溶液颜色不变,再向溶液中滴加2滴H2SO4溶液,溶液变蓝.
③向酸性的淀粉KI溶液中通入空气,溶液颜色不变.
下列对实验现象的解释或推测不合理的是( )
| A. | NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2═Cl-+ClO-+H2O | |
| B. | 根据实验可以得出中性条件下,氧化性Cl2>O2 | |
| C. | 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性 | |
| D. | 根据实验现象可以判断电解时阳极的电极反应式为:2Cl--2e-═Cl2↑ |
分析 石墨电极电解1mol/L氯化钠溶液,阳极依次发生:2Cl--2e-═Cl2↑,4OH--4e-═O2↑+2H2O,又已知:O2能使酸性的淀粉KI溶液变蓝,不能使中性的淀粉KI溶液变蓝,
则①将气体通入中性的淀粉KI溶液中,溶液变蓝,说明阳极Cl-放电发出氯气.
②用足量NaOH溶液充分洗气,气体体积减少,将剩余气体通入中性的淀粉KI溶液中,溶液颜色不变,再向溶液中滴加2滴H2SO4溶液,溶液变蓝,说明阳极Cl-全被放电,且部分OH-被氧化生成O2.
③向酸性的淀粉KI溶液中通入空气,溶液颜色不变,说明空气也不能使酸性的淀粉KI溶液变蓝,以此解答该题.
解答 解:A.用足量NaOH溶液充分洗气,气体体积减少即吸收氯气,反应的离子方程式为:2OH-+Cl2═Cl-+ClO-+H2O,故A正确;
B.根据实验得出,阳极依次发生:2Cl--2e-═Cl2↑,4OH--4e-═O2↑+2H2O,又将气体通入中性的淀粉KI溶液中,溶液变蓝,说明氯气氧化碘化钾,所以氧化性Cl2>O2,故B正确;
C.根据实验②③得出,O2能使酸性的淀粉KI溶液变蓝,不能使中性的淀粉KI溶液变蓝,空气也不能使酸性的淀粉KI溶液变蓝,所以反应物的浓度和溶液的pH会影响物质的氧化性,故C正确;
D.根据实验现象可以判断电解时阳极放出氯气和氧气,则电极反应式为:2Cl--2e-═Cl2↑,4OH--4e-═O2↑+2H2O,故D错误;
故选D.
点评 本题考查电解原理,侧重于学生的分析能力的考查,为高考高频考点,难度中等,注意把握离子的放电顺序,为解答该题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列选项中的气体能用如图装置制备,且所选试剂、干燥剂均正确的是( )
| 气体 | 所用试剂 | 干燥剂 | 装置(可加热) | |
| A | O2 | 氯酸钾和二氧化锰 | 无水氯化钙 |  |
| B | NH3 | 浓氨水和生石灰 | 碱石灰 | |
| C | H2 | 稀硝酸和锌粒 | 浓硫酸 | |
| D | SO2 | 浓盐酸和亚硫酸钠 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
9.下列说法不正确的是( )
| A. | 酿酒过程中,葡萄糖可通过水解反应生成酒精 | |
| B. | 丙烷和2-甲基丙烷的一氯代物均为两种 | |
| C. | 油脂发生皂化反应能生成甘油 | |
| D. | 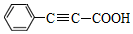 是高分子化合物 是高分子化合物 的单体 的单体 |
6.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 7.1 g 37Cl2含有的中子数为4NA | |
| B. | NA个Al(OH)3胶体粒子的质量为78 g | |
| C. | 7.8 g Na2O2晶体中阴阳离子总数为0.3NA | |
| D. | 标准状况下,2.24 L己烷含有的共价键数为1.9NA |
13.物质与其性质密切相关,下列说法错误的是( )
| A. | 硅胶可防止食物受潮是由于其具有吸水性 | |
| B. | 持续加热到一定温度能杀死甲型H1N1流感病毒是因为病毒蛋白质受热变性 | |
| C. | 纤维素在人体内可水解为葡萄糖是人类重要的营养物质之一 | |
| D. | 酸性重铬酸钾用于检查酒驾是利用其强氧化性 |
15.已知25℃时:
①HF(aq)+OH-(aq)=F-(aq)+H2O(l)△H1=-67.7kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l)△H2=-57.3kJ•mol-1
③Ba2+(aq)+SO42-(aq)=BaSO4(s)△H3<0
下列说法正确的是( )
①HF(aq)+OH-(aq)=F-(aq)+H2O(l)△H1=-67.7kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l)△H2=-57.3kJ•mol-1
③Ba2+(aq)+SO42-(aq)=BaSO4(s)△H3<0
下列说法正确的是( )
| A. | HF的电离方程式及热效应:HF(aq)?H+(aq)+F-(aq)△H>0 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,氢氧化钠溶液量越多,中和热越大 | |
| C. | △H2=-57.3 kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 |
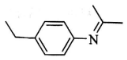 )有广泛应用.合成G的一种路径如图.1H-NMR谱显示C结构中只有一种环境的氢,且不能发生银镜反应,D的组成为C8H10.
)有广泛应用.合成G的一种路径如图.1H-NMR谱显示C结构中只有一种环境的氢,且不能发生银镜反应,D的组成为C8H10.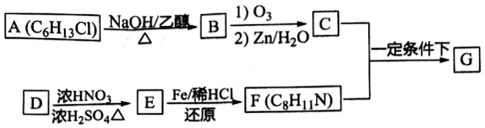
 $→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+
$→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+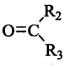
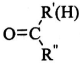 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +H2O
+H2O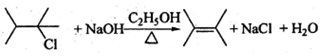 .
. .
.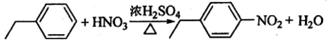 .
.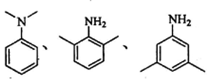 .
.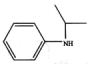 )的合成路线(流程图表示,无机试剂任选)
)的合成路线(流程图表示,无机试剂任选)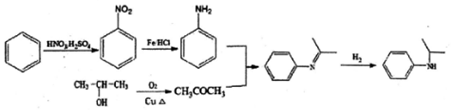 .
.


